
|
|
Уравнение состояния идеального газа. Изопроцессы.Соотношение p=nkT, связывающее давление газа с его температурой и концентрацией молекул, может быть записано в другой форме, устанавливающей связь между макроскопическими параметрами газа - объемом V, давлением p, температурой T и количеством вещества
Здесь N - число молекул в сосуде, NA - постоянная Авогадро, m - масса газа в сосуде, M - молярная масса газа. В итоге получим:
Произведение постоянной Авогадро NA на постоянную Больцмана k называется универсальной газовой постоянной и обозначается буквой R. Ее численное значение в СИ есть:R=8.31 Дж/моль·К.
называется уравнением состояния идеального газа.
Для одного моля любого газа это соотношение принимает вид: PV=RT. Если температура газа равна Tн=273.15 К(00 С), а давление pн=1 атм.=1.013·105 Па, то говорят, что газ находится при нормальных условиях. Как следует из уравнения состояния идеального газа один моль любого газа при нормальных условиях занимает один и тот же объем Vo, равный : Vo=0.0224 м3/моль=22.4 дм3/моль. Это утверждение называется законом Авогадро. Уравнение, устанавливающее связь между давлением, объемом и температурой газа было получено в середине 19 века французским физиком Клапейроном; оно было впервые записано и Д.И.Менделеевым. Поэтому уравнение состояния газа называется уравнением Клапейрона-Менделеева. Изопроцессы. Газ может участвовать в различных тепловых процессах, при которых могут изменяться все параметры, описывающие его состояние (p, V и T). Эти процессы могут быть изображены на диаграмме состояний (например, в координатах p, V) в виде некоторой траектории, каждая точка которой представляет равновесное состояние. Интерес представляют процессы, в которых один из параметров (p, V илиT) остается неизменным. Такие процессы называются изопроцессами.
pV=const.
На плоскости (p, V) изотермические процессы изображаются при различныхз начениях температуры T которые называются изотермами. Так как коэффициент пропорциональности в этом соотношении увеличивается с ростом температуры, изотермы, соответствующие более высоким значениям температуры, располагаются на графике выше изотерм, соответствующих меньшим значениям температуры (рис.). Уравнение изотермического процесса было получено из эксперимента английским физиком Р.Бойлем (1662 г.) и независимо французским физиком Э.Мариотттом (1676 г.). Поэтому это уравнение называют законом Бойля-Мариотта.
На плоскости (p, T) изохорные процессы для заданного количества вещества 4.Изобарный процесс (p=const) -называют процесс, протекающий при неизменным давлении p.Уравнение изобарного процесса для некоторого неизменного количества вещества
Контрольные вопросы и задания. Вопрос 1. Какая из приведенных формул является уравнением состояния идеального газа? 1. Вопрос 2. Как изменится давление идеального газа при увеличении абсолютной температуры и объема в 2 раза?
Вопрос 4. В баллоне при неизменной массе газа температура увеличилась от 100C до 500C. Как изменилось давление газа? Вопрос 5. На диаграмме V-Tпредставлен график зависимости объема идеального газа постоянной массы от абсолютной температуры. Как изменяется давление газа?
Вопрос 6. Как изменится температура идеального газа, если увеличить его объем в 2 раза при осуществлении процесса, описываемого формулой pV2=const?
Пример. Электрическая лампочка наполнена азотом при давлении p=0.8·105 Па. Объем колбы лампочки V=500 см3. Какой объем воды войдет в лампочку, если у нее отломить кончик под водой на глубине h=1 м? Атмосферное давление p0=105 Па. Решение. где V1 - объем азота после частичного заполнения колбы водой, p1 - установившееся давление в колбе - Гидростатическое давление Р= В колбу лампочки войдет V
Задача 1. При нагревании газа при постоянном объеме на Задача 2. Температура в комнате была равна t1=100C, а после того, как комнату натопили, температура поднялась до t2=200C. Объем комнаты V=50 м3, давление в ней постоянно и равно p=105 Па. Насколько изменилась масса воздуха в комнате? Молярную массу воздуха принять равной M=29·10-3 кг/моль. Задача 3. Определите молярную массу и молекулярную формулу некоторого соединения углерода с кислородом, если известно, что m=1 г этого вещества в газообразном состоянии создает в сосуде объемом V=1 дм3 при температуре t=270C давление p=0.56p0, где p0 - нормальное атмосферное давление. Атомные массы углерода и кислорода равны соответственно АC=12·10-3 кг/моль и АO=16·10-3 кг/моль. Задача 4. Определить температуру азота, имеющего массу 2 г, занимающего объем 830 см3 при давлении 0,2 МПа. Задача 5. Баллон вместимостью 40л содержит 1,98 кг углекислого газа. Баллон выдерживает давление не выше 30*105 Па. При какой температуре возникает опасность взрыва? Задача 6. Найти объём, который занимают 12 г азота при давлении 3,04 МПа и температуре 00С. Задача 7. Определить массу кислорода, занимающего объём 600л при температуре 300К и нормальном атмосферном давлении. Задача 8. Баллон электрической лампы при изготовлении заполняют азотом под давлением 50,65 кПа при температуре 288 К. Какова температура газа в горящей лампе, если давление в ней повысилось до 111 кПа?
Термодинамика
Внутренняя энергия. Количество теплоты. Работа в термодинамике Термодинамика - это наука о тепловых явлениях. Термодинамика рассматривает изолированные системы тел, находящиеся в состоянии термодинамического равновесия. Если термодинамическая система была подвержена внешнему воздействию, то в конечном итоге она перейдет в другое равновесное состояние. Такой переход называется термодинамическим процессом. Одним из важнейших понятий термодинамики является внутренняя энергия тела. С точки зрения молекулярно-кинетической теории внутренняя энергия вещества складывается из кинетической энергии всех атомов и молекул и потенциальной энергии их взаимодействия друг с другом. В частности, внутренняя энергия идеального газа равна сумме кинетических энергий всех частиц газа, находящихся в непрерывном и беспорядочном тепловом движении. Внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема (закон Джоуля). Внутренняя энергия идеального одноатомного газа (гелий, неон и др.), молекулы которого совершают только поступательное движение:
Работа численно равна площади под графиком процесса на (p, V) диаграмме.
Процессы, изображенные на рисунке, можно провести и в обратном направлении; тогда работа A просто изменит знак на противоположный. Процессы такого рода, которые можно проводить в обоих направлениях, называются обратимыми. Внутренняя энергия жидких и твердых тел, также может изменяться в результате совершения работы. При механической обработке деталей (например, при сверлении) они нагреваются. Это означает, что изменяется их внутренняя энергия. Внутренняя энергия тела может изменяться не только в результате совершаемой работы, но и вследствие теплообмена. При тепловом контакте тел внутренняя энергия одного из них может увеличиваться, а внутренняя энергия другого - уменьшаться. В этом случае говорят о тепловом потоке от одного тела к другому. Количеством теплоты Q, полученной телом, называют изменение внутренней энергии тела в результате теплообмена. Передача энергии от одного тела другому в форме тепла может происходить только при наличии разности температур между ними. Тепловой поток всегда направлен от горячего тела к холодному. Количество теплоты Q является энергетической величиной. В СИ количество теплоты измеряется в единицах механической работы - джоулях (Дж). 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
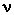 . Для этого нужно использовать равенства:
. Для этого нужно использовать равенства: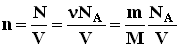
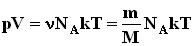
 Соотношение
Соотношение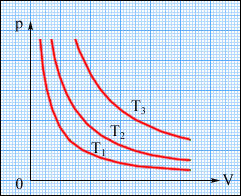 1.Изотермический процесс (T=const) - называют процесс, протекающий при постоянной температуре T. Из уравнения состояния идеального газа следует, что при постоянной температуре T и неизменном количестве вещества
1.Изотермический процесс (T=const) - называют процесс, протекающий при постоянной температуре T. Из уравнения состояния идеального газа следует, что при постоянной температуре T и неизменном количестве вещества 
 2.Изохорный процесс (V=const )- это процесс нагревания или охлаждения газа при постоянном объеме V и при условии, что количество вещества
2.Изохорный процесс (V=const )- это процесс нагревания или охлаждения газа при постоянном объеме V и при условии, что количество вещества 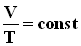 На плоскости (V, T) изобарные процессы при разных значениях давления p изображаются семейством прямых линий (рис.), которые называются изобарами. Зависимость объема газа от температуры при неизменном давлении была экспериментально исследована французским физиком Ж. Гей-Люссаком (1862 г.). Поэтому уравнение изобарного процесса называют законом Гей-Люссака.
На плоскости (V, T) изобарные процессы при разных значениях давления p изображаются семейством прямых линий (рис.), которые называются изобарами. Зависимость объема газа от температуры при неизменном давлении была экспериментально исследована французским физиком Ж. Гей-Люссаком (1862 г.). Поэтому уравнение изобарного процесса называют законом Гей-Люссака. . 2.
. 2.  .
.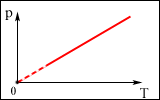 Вопрос 3. Какому процессу соответствует график на рис. ?
Вопрос 3. Какому процессу соответствует график на рис. ?
 .
. водяного столба на глубине h=1 м равно 104 Па, т.е. составляет 0.1p0. Таким образом,
водяного столба на глубине h=1 м равно 104 Па, т.е. составляет 0.1p0. Таким образом,  см3.
см3. V1=140 см3 воды.
V1=140 см3 воды. давление увеличилось на 0.2%. При какой начальной температуре T0 находился газ?
давление увеличилось на 0.2%. При какой начальной температуре T0 находился газ?
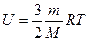
 Таким образом, внутренняя энергия U тела однозначно определяется макроскопическими параметрами, характеризующими состояние тела. Внутренняя энергия тела может изменяться, если действующие на него внешние силы совершают работу (положительную или отрицательную). Например, если газ подвергается сжатию в цилиндре под поршнем, то внешние силы совершают над газом некоторую положительную работу A'. В то же время силы давления, действующие со стороны газа на поршень, совершают работу A=-A'. Если объем газа изменился на малую величину
Таким образом, внутренняя энергия U тела однозначно определяется макроскопическими параметрами, характеризующими состояние тела. Внутренняя энергия тела может изменяться, если действующие на него внешние силы совершают работу (положительную или отрицательную). Например, если газ подвергается сжатию в цилиндре под поршнем, то внешние силы совершают над газом некоторую положительную работу A'. В то же время силы давления, действующие со стороны газа на поршень, совершают работу A=-A'. Если объем газа изменился на малую величину  , то газ совершает работу
, то газ совершает работу  , где p - давление газа, S - площадь поршня,
, где p - давление газа, S - площадь поршня,  - его перемещение. При расширении работа, совершаемая газом, положительна, при сжатии - отрицательна. В общем случае при переходе из некоторого начального состояния (1) в конечное состояние (2) работа газа выражается формулой:
- его перемещение. При расширении работа, совершаемая газом, положительна, при сжатии - отрицательна. В общем случае при переходе из некоторого начального состояния (1) в конечное состояние (2) работа газа выражается формулой:  .
. Величина работы зависит от того, каким путем совершался переход из начального состояния в конечное. На рисунке изображены три различных процесса, переводящих газ из состояния (1) в состояние (2). Во всех трех случаях газ совершает различную работу.
Величина работы зависит от того, каким путем совершался переход из начального состояния в конечное. На рисунке изображены три различных процесса, переводящих газ из состояния (1) в состояние (2). Во всех трех случаях газ совершает различную работу.