|
|
Алюминиевые покрытия, полученные электролитическим методомОдним из способов получения алюминиевой металлизации является электролитическое алюминирование. Особенностью электроосаждения алюминия является то, что он не может быть выделен путем электролиза водных растворов в виду того, что стандартный электродный потенциал алюминия (Е° = –1,66 В) намного отрицательнее потенциала выделения водорода из воды (Е° = –0,41 В). Поэтому в качестве растворителей используют органические апротонные, например, толуол или ксилол, которые не содержат подвижных атомов водорода. Эти растворители имеют высокую электрохимическую устойчивость и не восстанавливаются до потенциалов –(3-3,5) В, а их анодное окисление близко к 1,0-1,5 В. Основными растворяемыми компонентами в этих электролитах являются ионы металлов, а также органические и неорганические соединения, обладающие высокой растворимостью и электропроводностью. Для практического применения разработано достаточно большое число электролитов алюминирования. Однако, как показали исследования, не все электролиты могут быть использованы для осаждения алюминия. Из числа разработанных электролитов можно выделить следующие группы, нашедшие практическое применение: эфирно-гидридные, алюмоорганические, этилбромидные, алкилбензольные и алкилбензольные с четвертичными аммониевыми соединениями. Из анализа литературных данных по электролитам алюминирования можно заключить, что все они неустойчивы, а алюминиевые покрытия, осаждаемые в узком диапазоне катодной плотности тока, имеют недостаточную адгезию к основе и неудовлетворительную структуру. Процесс электролиза затруднен использованием инертной атмосферы и закрытых электролизеров, поскольку при контакте электролитов с атмосферной влагой они разлагаются, а в некоторых случаях становятся взрывоопасными. Кроме того, отмывка деталей, покрытых алюминием, после электролиза осуществляется в органических растворителях. Все эти факторы ограничивают использование электролитов алюминирования в промышленном масштабе. Наиболее стабильные результаты получены при электроосаждении алюминия из алкилбензольных электролитов. Перспективными следует считать ксилольные, при этом можно использовать как отдельные изомеры ксилола, так и их смесь.
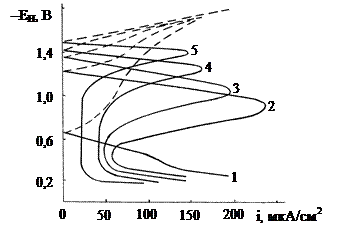
Наиболее систематические исследования кинетики и механизма электроосаждения алюминия из алкилбензольных электролитов, в том числе ксилольных, проведены Симанавичусом. В соответствии с развиваемой теорией электроосаждения алюминия из ксилольных электролитов был предложен механизм осаждения алюминия по схеме: [Al2Br4OH · C6H4 (CH3)2]+ + C6H4 (CH3)2H+ + 6e → 2Al° + 4Br– + H2O + 2 C6H4 (CH3)2. Образующиеся в процессе электролиза различные комплексные ионы, а также протекающие под действием электрического тока сложные химические превращения усложняют выделение алюминия. По этой причине алюминиевые покрытия осаждаются сравнительно небольшой толщины (до 20 мкм). Следует отметить, что анодное поведение гальванического алюминия в различных средах изучено в меньшей степени, чем электрометаллургического, который получают электролизом расплава оксида алюминия в смеси с криолитом. Коррозионно-электрохимические свойства алюминиевых покрытий в нейтральной среде исследовались в растворе, имитирующем конденсат влаги промышленной атмосферы (КПА) состава (моль/л): NaCl – 0,01; Na2SO4 – 0,001; Na2SO3 – 0,001. Алюминиевые покрытия получали из ксилольного электролита состава (г/л): бромид алюминия – 500, парафин – 5,0, ксилол – остальное. Электроосаждение алюминиевых покрытий осуществляли на медную основу. Анодные потенциодинамические кривые снимались по известной методике, применяя катодную активацию при Е = –2 В. Из анодных поляризационных кривых (рис. 6.13) видно, что эти кривые имеют характерные для пассивного металла, каким является алюминий, три кинетические области: активного растворения, активно-пассивного состояния и перепассивации.
Рис. 6.13. Потенциодинамические кривые алюминиевых покрытий, полученных из ксилольного электролита без добавок, в зависимости от iк (А/дм2): 1 – 1,0; 2 – 1,5; 3 – 2,0; 4 – 2,5; 5 – 4,0; 6 – 5,0; 7 – Alметаллург. (А99,99). Время электролиза
Активное растворение алюминия происходит в соответствии с реакцией: Al – 3e = Al3+ при потенциалах от –1,58 до –1,34 В. В этом интервале потенциалов наблюдается появление максимума, которое обусловлено возникновением защитной пленки по реакции: 2Al + 3H2O +6e = Al2О3 + 6H+ При дальнейшем смещении потенциала в положительную область скорость растворения алюминия замедляется и при потенциале пассивации Еп » 1,4 В становится равной скорости образования защитной оксидной пленки, при этом достигается предельный ток пассивации iп. При потенциалах, положительнее Еп, скорость роста оксидной пленки превышает скорость ее химического растворения и формируется защитная пленка, появляется характерный аномальный участок на анодной кривой, при этом ток резко снижается до значения полной пассивации iпп » 25 мкА/см2. При дальнейшем увеличении потенциала до –(0,66-0,6) В алюминий находится в активно-пассивном состоянии, при котором скорость анодного процесса практически не зависит от потенциала и в основном определяется скоростью химического растворения защитной пленки в электролите. В присутствии хлорид-ионов (концентрация их в КПА равна 10–2 г-ион/л) происходит постепенное вытеснение ими кислорода из защитной пленки и адсорбированного кислорода с поверхности электрода. Вследствие этого при достижении потенциала пробоя Епр ≈ 0,6 В оксидная пленка не возобновляется за счет прямого окисления. Анодный процесс образования защитного оксида заменяется анодным процессом образования легкорастворимого соединения металла с активным анионом и гидроксида алюминия: Al + 3Cl– – 3e = Al3; Al + 3OH– – 3e = Al(OH)3. Образование этих соединений затрудняет доступ кислорода к поверхности электрода и пассивацию алюминия. Из рис. 6.13 видно, что на характер анодных поляризационных кривых влияет величина катодной плотности тока iк, при которой осаждается алюминий. С увеличением iк потенциал пассивации практически не изменяется. Это свидетельствует о том, что не изменяется природа пассивирующего слоя на поверхности алюминия в данной среде. Однако при этом видно, что заметное влияние катодная плотность тока iк оказывает на ток пассивации, который возрастает примерно в 5 раз (от 5 до 250 мкА/см2) при увеличении iк от 1 до 4 А/дм2. Пробой оксидной пленки наступает при потенциале Епр. ≈ –0,6 В и не зависит от iк. Для электрометаллургического алюминия (А99,99) Епр положительнее на 0,4 В (рис. 6.13, кривая 7). Очевидно, на величину Епр оказывает влияние условие формирования защитной оксидной пленки, которая на гальваническом алюминии образуется более пористой и не такой сплошной, как на металлургическом алюминии. Для количественной оценки защитных свойств гальванопокрытий применяется метод построения коррозионных диаграмм, позволяющий определить суммарный коррозионный ток в системе основа – гальванопокрытие. В соответствии с этим методом на катодные (или анодные) поляризационные кривые переносят значения стационарных потенциалов изучаемой системы. Определено влияние режимов электролиза при получении алюминиевых гальванопокрытий на коррозионный ток iкор в КПА и установлено, что с увеличением катодной плотности тока iкор постепенно снижается, т. к. возрастает толщина покрытий и соответственно снижается их пористость. С увеличением продолжительности электролиза стационарный потенциал Ест системы алюминий гальванический – медная основа, сдвигается в отрицательную сторону, что объясняется увеличением толщины покрытий и снижением пористости. Поскольку сквозных пор становится меньше, поэтому Ест по отношению к медной основе определяется природой алюминия и свойствами его защитной пленки.

Рис. 6.14. Микроструктура поверхности алюминиевых покрытий, полученных из ксилольного электролита без добавок (а), с добавками парафина (б) и ДДДМ (в). Увеличение 2000х
Табл. 6.5. Зависимость скорости коррозии гальванического алюминия с различной толщиной (δ), полученного из ксилольных электролитов с добавкой ДДДМ, в КПА
С увеличением концентрации ДДДМ до 5 г/л изменяется характер анодных кривых, что особенно заметно при повышении τэл до 30 мин. Анодные кривые характеризуются появлением катодного участка при потенциалах от –1,63 до –1,2 В, так называемой «катодной петли» (рис. 6.15), наличие которой указывает на переход системы из активного в пассивно-активное состояние, т. е. относительно большей устойчивости пассивного состояния коррозионной системы. Подтверждением этому является сдвиг Ест в отрицательную сторону, что свидетельствует об уменьшении пористости гальванопокрытий при увеличении концентрации ДДДМ в электролите. Например, при изменении концентрации ДДДМ от 0,5 до 5 г/л потенциал алюминия становится отрицательнее на 0,4 В. Это приводит к снижению токов коррозии (табл. 6.5) в 20 раз ( при iк = 1 А/дм2 и τ = 30 мин).
Рис. 6.15. Потенциодинамические кривые алюминия, полученного из ксилольного электролита с добавкой 5 г/л ДДДМ и τ (мин): 1 – 10 ; 2 – 20 ; 3 – 30
При повышении iк от 0,5 до 2 А/дм2 потенциал алюминия также смещается в отрицательную сторону, а на анодных кривых появляются «катодные петли». Из анализа коррозионных диаграмм (табл. 6.5) следует, что при низкой концентрации ДДДМ снижается устойчивость алюминия, а с повышением концентрации добавки до 5 г/л она заметно повышается. Более коррозионно устойчивыми являются алюминиевые покрытия, полученные из ксилольного электролита с добавкой 5 г/л ДДДМ (iкор=10 мкА/см2) при iк = 1,0 А/дм2 и τ = 30 мин). Отжиг алюминиевых покрытий влияет на характер E, i‑кривых в КПА. Из рис. 6.16 видно, что на анодных кривых неотожженного алюминия, полученного из ксилольного электролита с ДДДМ, отсутствуют участки активного и пассивного состояний, которые появляются при отжиге. Это обусловлено особенностями структуры алюминия. Исследования поверхности покрытий показали, что электролитический алюминий имеет поликристаллическую структуру с малым размером зерен. Очевидно, на алюминии, не подвергнутом отжигу, поверхностная оксидная пленка тонкая и пористая, что подтверждается высоким значением iкор = 100-200 мкА/см2.
Рис. 6.16. Потенциодинамические кривые неотожженного (1) и отожженного алюминия, снятые в КПА. Температура отжига, °С : 2 – 350, 3 – 450, 4 – 550, 5 – Al металлургический (А99,99)
Отжиг при 350 °С повышает коррозионную стойкость алюминиевых покрытий примерно в 3,5 раза, причем на Е-i-кривых появляются активная и пассивная области (рис. 6.16, кривая 2). С повышением температуры отжига до 550 °С область пассивации расширяется с 0,06 до 0,45 В, ток пассивации снижается с 240 до 165 мкА/см2 (табл. 6.6), а Е, i-кривая приобретает сходство с кривой электрометаллургического алюминия (рис. 6.16, кривая 5), при этом область пассивации несколько уже, а ток полной пассивации выше, чем у последнего (iпп = 45 мкА/см2) примерно в 1,8 раза.
Табл. 6.6. Cтационарные потенциалы (Ест.) и погружения (Епогр.), ток пассивации (iп) и полной пассивации (iпп) электролитического алюминия в КПА при
В присутствии Cl–-ионов алюминий склонен к питтингообразованию. С увеличением температуры отжига коррозионная стойкость возрастает. В литературе имеются данные о том, что при уменьшении размера зерна, например, стали Х18Н10Т склонность к питтинговой коррозии возрастает. Следует отметить, что при образовании оксидов на металлах имеют место явления ориентационного соответствия, когда структура поверхностной пленки повторяет структуру металла. Поэтому можно предположить, что низкая коррозионная стойкость электролитического неотожженного алюминия обусловлена формированием дефектной защитной пленки. С увеличением температуры отжига растет размер зерна (при Т = 450 °С до 0,83 мкм), структура покрытий характеризуется более правильной формой кристаллов. Гранулы зерен становятся менее дефектными, на поверхности алюминия образуется пленка с лучшими защитными свойствами.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|

 = 15 мин
= 15 мин