|
|
Физико-химические основы процесса синтеза карбамидаКарбамид (мочевина) (NH2)2СО представляет собой амид карбаминовой кислоты Н2СООН. Структурная формула карбамида NH2 / О = С \ NH2
Данные, характеризующие физико-химические свойства карбамида: - плотность при 25 °С 1330 кг/м3 - молекулярная масса 60,056 кг/кмоль - температура плавления при атмосферном давлении 132,7 °С - удельная теплоемкость при 20 °С 1,35 кДж/г - теплота плавления 242 Дж/г - теплота образования из простых веществ 6333,5 кДж/моль - теплота растворения в воде 242 Дж/г
Качество выпускаемого приллированного карбамида с кондиционирующими добавками и без добавок должно соответствовать требованиям ГОСТ 2081-92 марки Б высшего сорта, которые представлены в таблице 5.2.
Таблица 5.2
Особенностью технологического процесса фирмы "Стамикарбон" является разложение карбамата аммония, непрореагировавшего в карбамид, при давлении в стадии синтеза, путем тепловой обработки раствора, выходящего из реактора, в токе свежего диоксида углерода – так называемый стриппинг процесс. Контур высокого давления в технологической схеме предложенной фирмой "Стамикарбон" включает в себя реактор для образования карбамида, узел стриппинга - дистилляции (стриппер и карбаматный конденсатор) и узел промывки инертных, по отношению к реакции синтеза, газов от аммиака и диоксида углерода (скруббер). Большая часть, из не прореагировавших в колонне синтеза (реакторе), аммиака и диоксида углерода отгоняется из плава синтеза при температурной обработке в токе свежего диоксида углерода в стриппере. Газовую фазу из стриппера, поступающую в карбаматный конденсатор, полностью не конденсируют с целью использования тепла выделившегося при образовании карбамата, в реакторе при синтезе карбамида. Образующаяся газожидкостная смесь поступает в реактор, который работает при давлении не более 14,1 МПа. Плав синтеза из реактора подается в стриппер, и контур замыкается. Карбамид получают взаимодействием аммиака и диоксида углерода по следующим реакциям: - образование карбамата аммония 2NН3 + СО2 NН2СООNН4 + 157,84 КДж/моль (37,70 Ккал/моль) - его дегидратация NН2СООNН4 NН2СОNН2 + Н2О - 15,78 КДж/моль (3,70 Ккал/моль) Для смещения равновесия экзотермической реакции вправо к образованию карбамата процесс проводится в конденсаторе под давлением синтеза и с избытком аммиака. Реакция превращения карбамата в карбамид - эндотермическая и проводится при температуре 183°С в реакторе. При оптимальном ведении технологического режима степень конверсии диоксида углерода в карбамид достигает проектной величины - 57 %. Обе реакции являются обратимыми, состояние равновесия определяется условиями, при которых проводится синтез карбамида и зависит от ряда факторов: температуры, давления, плотности загрузки аппарата (степени его заполнения), соотношения между аммиаком и углекислым газом, количества воды, вводимой с исходными реагентами в реактор, времени пребывания реагентов в зоне реакции. Обе реакции являются обратимыми, состояние равновесия определяется условиями, при которых проводится синтез карбамида и зависит от ряда факторов: температуры, давления, плотности загрузки аппарата (степени его заполнения), соотношения между аммиаком и диоксидом углерода, количества воды, вводимой с исходными реагентами в реактор, времени пребывания реагентов в зоне реакции.
где N - степень превращения карбамата аммония в карбамид (выход), %; Р - плотность заполнения реактора, г/см3. Примечание: результаты получены при температуре 170 °С.
где N - число молей Н2О на 1 моль карбамата аммония; Х - равновесная степень превращения карбамата аммония в карбамид (выход), %. Примечание: данные получены при температуре от 150 °С до 160 °С и плотности заполнения реактора от 0,5 до 0,9 г/см3. Рассмотрим влияние давления на состояния равновесий реакций образования карбамата аммония из диоксида углерода и аммиака, и его последующей дегидратации. Давление оказывает значительное влияние на скорость образования карбамата аммония. Скорость образования карбамата аммония возрастает пропорционально квадрату давления. При нормальной температуре и атмосферном давлении скорость образования карбамата аммония очень мала, а при давлении 10,0 МПа (100 кгс/см2) и температуре 150 °С реакция протекает мгновенно. Так как реакция образования карбамида равновесная, и раствор из реактора содержит еще значительное количество не прореагировавших аммиака и диоксида углерода, то очень важно быстро удалить аммиак и диоксид углерода, чтобы максимально ограничить процесс гидролиза карбамида. Стриппинг раствора диоксидом углерода позволяет ограничить процесс гидролиза, тем более что давление в узле синтеза фактически определяется количеством диоксида углерода и аммиака, которые содержатся в выходящем растворе из реактора.
где Х - выход карбамида, %; Р - давление, МПа (кгс/см2). Рассмотрим влияние температуры на состояния равновесий реакций образования карбамата аммония из диоксида углерода и аммиака, и его последующей дегидратации. С повышением температуры равновесие реакции сдвигается в сторону образования карбамида, что иллюстрируется
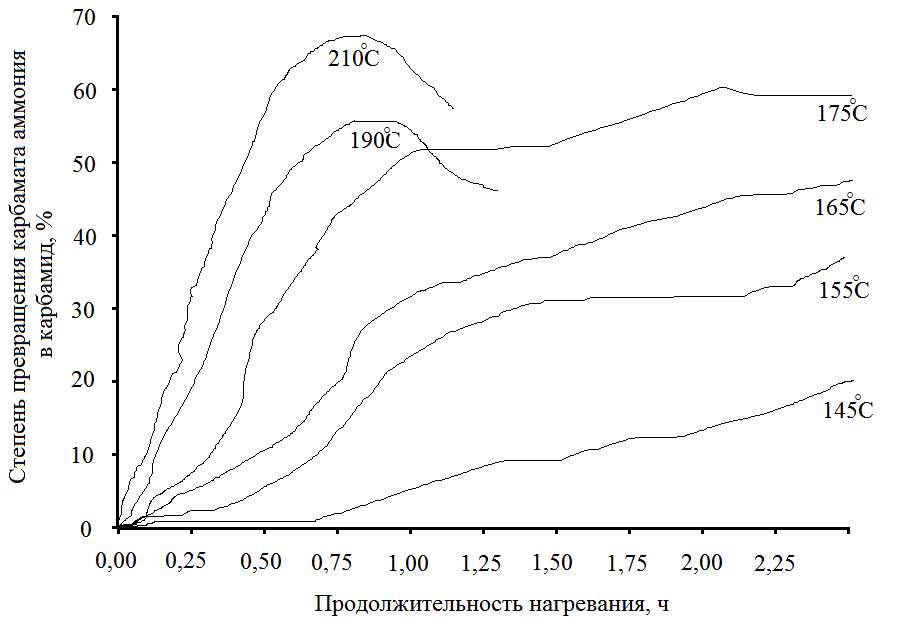
гдеТ - температура, °С; Х - выход карбамида, %. Примечание: результаты получены при плотности заполнения реактора 1,0 г/см2. Однако, влияние температуры на равновесие невелико: при температуре 140°С степень конверсии диоксида углерода в карбамид составляет 43 %, а при повышении температуры до 190 °С выход увеличивается на 6,8 %. Более значительное влияние оказывает изменение температуры на скорость дегидратации карбамата аммония. Зависимость скорости дегидратации карбамата аммония от температуры приводится на рисунке 5.6
гдеС - выход карбамида по диоксиду углерода от теоретического; Т - время. результаты получены при соотношении NН3 : СО2 = 2. Повышение температуры значительно увеличивает скорость реакции. При 155°С предельная скорость реакции достигает через 4 часа; при 170 °С - через 2 часа; при 180 °С - через 1,5 часа. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|