
|
|
Физико-химические основы контактного окисления аммиака. Виды катализаторов. Оптимальный технологический режимВ результате окисления могут образовываться различные продукты в зависимости от условий: 4NH3+5O2=4NO+6H2O+90,7кДж(1); 4NH3+4O2=2N2O+6H2O+1104,4кДж(2); 4NH3+3O2=2N2+6H2O+1269кДж(3); Все реакции идут при повышенной Т => могут быть и побочные реакции Необходимо подобрать условия, чтобы протекала только 1-я реакция.т. к. только она может привести к образ HNO3. Все реакции являются сильно экзотермическими и необратимыми Кр1=10-53, Кр2=10-61, Кр3=10-67 =>Наиболее вероятной является 3-я реакция, но она приводит к образованию элементарного азота. Если осуществлять процесс без катализатора, то продуктом окисления будет элементарный азот. Чтобы получить 1-ю реакцию, необходимо подобрать селективный и активный катализатор, который будет ускорять 1-ю реакцию. Таким является катализатор на основе металлической Pt. Применяют катализаторы: Fe,Cr,Co,Mn. Все эти катализаторы по селективности, активности, сроку службы уступают Pt-му катализатору. Время контакта газ смеси с катализатором 10-4сек, выход NO 98% - на других катализаторах этого слоем неPt-го катализатора. Pt-вый kat чувствительный к примесям.Наиболее отравляющее действие оказывает PH3,H2S,сернистые соединения,SO2,механические загрязнения из воздуха и NH3.Воздух и NH3 подвергают очисткеот неорганических соединений и от пыли. Очистка от соединений S достичь нельзя. Применяют тонкую Pt-ую проволоку d=0,045-0,094мм. Чтобы достичь времени контактирования 10-4сек устанавливают несколько таких сеток. (-) kat При Т=800-9000 происходит разрушение Pt-го kat. Нити из проволоки разрыхляются и происходит унос Pt с поверхности катализатора вместе с нитрозными газами. Необходимо улучшать физ-хим свойства Pt-вой проволоки(термоустойчивость,прочность), т.е. надо вводить легирующие добавки. Используют не чистую Pt, а сплавы Pt с различными легирующими элементами(Co,V,Mo,W,Mn,Ni), которые ↑ прочность и термоустойчивость.Могут Pt-вые сплавы содержать Rh,Pd,Ro,Ru. Это позволяет ↓ потери Pt, ↑селективность окисления на 2-3% выше, чем на чистой Pt. Обнаруживают большое кол-во оксидов kat: Co2O3,Fe2O3,Cr2O3,MnO2, но они существенно уступают Pt-вым, они быстро теряют свою активностьть. В промышленных условиях наибольшее распространение получили комбинированные катализаторы, в которых часть Pt-вых сеток заменены осуществляется абсорбцией водой Механизм окисления: 4NH3+5O2=4NO+6H2O- это суммарная реакция, а процесс окисления состоит из большого числа стадий: 1)диффузия реагирующих веществ из объема газовой фазы к поверхности kat. 2)активированная адсорбция NH3 и О2 на поверхности kat 3)Химическое взаимодействие с образованием на поверхности kat оксидов азота и воды 4)десорбция с поверхности kat 5)диффузия с поверхности kat в реакционную среду Чтобы выявить lim стадию проводят исследования: при недостатке О2 или при стехиометрическом соотношении lim является стадия адсорбции О2; при избытке О2lim является диффузия молекул NH3 к поверхности kat. Выход NO при окислении NH3 кислородом зависит: - от Т газовой смеси; - от времени контакта; - от соотношения реагирующих компононтов; - от давления;
Оптимальный режим 800-9000 => реакционную смесь перед аппаратом надо подогревать. Max выход при 900-9200, но при ↑ Т будут потери Ptkat => процесс надо вести при Т=8000 (под Ратм). В системах с повышенным Р используют ↑ Т. В наст время Р=0,4-0,8МПа, это требует ↑ Т до 800-8500
Время контакта реагирующих компонентов с kat.
Влияние Р. 4NH3+5O2=4NO+6H2O+Q- ↑Р приводит к ↓ выхода NO, при ↑ Р ↑СNH3 за счет ↓ V, ↑ ρ газовой смеси. Т.к. образуется NO только на поверхности kat, то время, необходимое для окисления NH3 ↑, т.к. каждая молекула NH3 должна адсорбироваться на kat. Чтобы компенсировать ↓ выхода NO
26. Абсорбция оксидов азота осуществляется водой: 3NO2+H2O = 2HNO3+NO+Q Это суммарное уравнение, оно не отражает настоящего механизма процесса. Реакция обратимая, экзотермическая и сопровождается уменьшением обьема и выделением вторичного оксида азота. 2NO2+H2O = 2HNO3+HNO2+Q N2 O4+H2O = HNO3+HNO2 N2O3+H2O = 2HNO2 Все оксиды азота (кроме NO) взаимодействуют с водой. Азотистая кислота неустойчивое соединение, существует при низких температурах в разбавленных растворах. В реальных условиях: 3HNO2=2HNO3+2NO+ H2O 2NO2+H2O = 2HNO3+HNO2 3HNO2=HNO3+2NO+ H2O 3NO2+H2O = 2HNO3+NO За один цикл в азотную кислоту превращается 2/3 NO2 , а 1/3 выделяется в газовую фазу в виде NO. 2NO+О2=2NO2 Процесс абсорбции должен сопровождаться окислением вторичного оксида азота. Общее количество NO в первом цикле 1 моль, во втором – 2/3 моль, в третьем- 1/3*2/3 моль. Нужны такие условия, чтобы одновременно с окислением вторичного оксида азота происходила абсорбция NO(маленькая температура и повышенное давление). Движущая сила абсорбции с увеличением давления и уменьшением температуры будет уменьшаться. Движущей силой является разность концентраций NO2 в газовой фазе – концентрации NO2 над HNO3. Чтобы увеличить движущую силу надо увеличить концентрацию NO2 в г.ф. и уменьшать равновесное порциальное давление NO2 над HNO3. Эти условия совпадают с условиями окисления NO2, следовательно, процессы можно вести в одном аппарате. По мере протекания абсорбции С(HNO3) увеличивается, увеличивается и давление оксидов азота, а движущая сила процесса уменьшается(когда становится =0 абсорбция прекращается). Получить 100% HNO3 при абсорбции оксида азота водой невозможно. 3NO2+H2O = 2HNO3+NO+136,2кДж Кр= (РNO2*Р2HNO3)/Р3NO2*Р H2O К1= РNO2/ Р3NO2 , К2= Р2HNO3/ РH2O Кр=К1*К2, К1 и К2 зависят от температуры и концентрации HNO3, а Кр – только от Т. К2 определяется по давлению паров над HNO3, а К1 по порциальному давлению оксида азота над HNO3. Зная Кр и состав исходного нитрозного газа можно рассчитать равновесную степень превращения оксида азота при любых значениях температуры и концентрации HNO3. По мере протекания процесса концентрация NO2 уменьшается. С увеличением температуры и концентрации HNO3 степень превращения оксида азота в азотную кислоту резко уменьшается. При концентрации HNO3>60% степень превращения почти = 0. Т.е поглощение оксида азота прекращается, т.к. резко уменьшается движущая сила процесса. При абсорбции оксида азота водой нельзя получить азотную кислоту с концентрацией >65%. Нельзя добиться полного поглощения оксида азота, т.к. всегда выделяется вторичный оксид азота. 3NO2+H2O = 2HNO3+NO В отходящих газах всегда есть какое-то количество оксидов азота, значит нужно обезвреживать. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 Влияние Т. Процесс надо вести с kat=> Т зависит от Тзаж и его термоустойчивости. Тзаж(Pt)=2000: реакция окисления начинается при такой Т. При меньшей Т основной продукт окисления – N2O; NO будет при Т>2500.При ↑ Т выход ↑. Max выход при 800-9000- 98%.100% не может быть, т.к. протекает побочные реакции с образованием N2O
Влияние Т. Процесс надо вести с kat=> Т зависит от Тзаж и его термоустойчивости. Тзаж(Pt)=2000: реакция окисления начинается при такой Т. При меньшей Т основной продукт окисления – N2O; NO будет при Т>2500.При ↑ Т выход ↑. Max выход при 800-9000- 98%.100% не может быть, т.к. протекает побочные реакции с образованием N2O Соотношение NH3 и O2. 4NH3+5O2=4NO+6H2O – Окисление проводят не чистым О2, а воздухом(21% О2), т.е. по уравнению на 1 моль NH3 должно быть 1,25 моль О2. При стехиометрическом соотношении выход NO ↓. Чтобы выход был ↑ берут избыток О2 => изб О2 должен быть 1,7-2(по графику) – СNH3 всегда будет < теоретического СNH3=10,5-12%. Смесь NH3 с воздухом взрывоопасна. СNH3 не должна быть=16-25%.
Соотношение NH3 и O2. 4NH3+5O2=4NO+6H2O – Окисление проводят не чистым О2, а воздухом(21% О2), т.е. по уравнению на 1 моль NH3 должно быть 1,25 моль О2. При стехиометрическом соотношении выход NO ↓. Чтобы выход был ↑ берут избыток О2 => изб О2 должен быть 1,7-2(по графику) – СNH3 всегда будет < теоретического СNH3=10,5-12%. Смесь NH3 с воздухом взрывоопасна. СNH3 не должна быть=16-25%.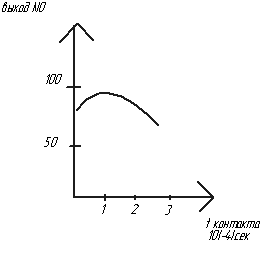 При малом времени контактирования NH3 не успевает адсорбироваться на kat и часть молекул проскакивает за kat-кую сетку, за которой идет взаимодействие. Выход NO ↓ при ↑ врем контактир, т.к. молекулы NH3 в зоне ↑ Т могут взаимодействовать с О2 еще до поступления на сетку.
При малом времени контактирования NH3 не успевает адсорбироваться на kat и часть молекул проскакивает за kat-кую сетку, за которой идет взаимодействие. Выход NO ↓ при ↑ врем контактир, т.к. молекулы NH3 в зоне ↑ Т могут взаимодействовать с О2 еще до поступления на сетку. надо ↑ Т, а это влечет потери kat. Оптим Р=0,35МПа. ↑ Р ведет к ↑ интенсивности, ↑ размеров аппарата, но и ведет к ↑ Т. Агрегаты АК-72 позволяют снизить Т.
надо ↑ Т, а это влечет потери kat. Оптим Р=0,35МПа. ↑ Р ведет к ↑ интенсивности, ↑ размеров аппарата, но и ведет к ↑ Т. Агрегаты АК-72 позволяют снизить Т.