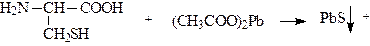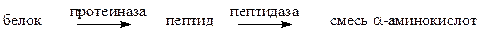|
|
Элиминирование - побочный процесс нуклеофильному замещению
Тема: Реакции нуклеофильного присоединения
Атака нуклеофилом:
Гидратация:
Присоединение спиртов и тиолов (АN).
Образование ацеталей (кеталей) протекает по механизму
Замещение карбонильного кислорода на азотсодержащие группировки
Реакция с первичными аминами (образование иминов - оснований Шиффа)
Аналогично реагируют NH2OH, H2N-NH2, NH2–NHR, H2N-NH-CO-NH2.
Реакции SN для альдегидов и кетонов
Окисление: Галоформное расщепление:
Реакции с участием СН-кислотного центра
1. Реакция альдольного присоединения (щелочной катализ):
2. Реакция альдольного присоединения (кислотный катализ):
3. Конденсация Канницарро – самоокисление-самовосстановление:
Тема: Аминокислоты. Пептиды. Белки Аминокислоты – гетерофункциональные соединения, содержащие NH2- и COOH-группы. Различают α, β, γ, δ-аминокислоты в зависимости от взаимного расположения двух групп. Концевую аминогруппу обозначают
Классификация и номенклатура аминокислот Общая формула всех аминокислот: Исключение:
В зависимости от кислотно-основных свойств выделяют:
НЕЗАМЕНИМЫЕ АМИНОКИСЛОТЫ:
ПОЛУНЕЗАМЕНИМЫЕ: ЧАСТИЧНОЗАМЕНИМЫЕ: Стереоизомерия α-аминокислот
Все аминокислоты (кроме глицина) имеют асимметрический атом углерода и существуют в виде двух энантиомеров:
Способы получения аминокислот 1. Гидролиз белков (in vitro). 2. Аминирование α–галогенкарбоновых кислот:
3. Синтез Штреккера:
4. Восстановление производных α-кетокислот (восстановительное аминирование):
Химические свойства 1. Кислотность-основность
неионизированная форма цвиттер-ион
Кислотно-основные свойства аминокислот количественно характеризуют значениями рКа кислотной группы (в том числе и боковых радикалов) и рI – изоэлектрической точкой (см. учебник Н.А. Тюкавкиной «Биоорганическая химия»). Изоэлектрическая точка соответствует значению рН, при котором концентрация диполярных ионов максимальна, а минимальные концентрации катионной и анионной форм равны. В изоэлектрической точке суммарный заряд молекулы равен 0.
Три группы аминокислот дают разные равновесные системы: - нейтральные – три формы
катион цвиттер-ион анион
- кислые (анионогенные) содержат в радикале дополнительно карбоксильную группу и образуют равновесные системы из 4-х форм:
- основные (катионогенные) содержат в радикале дополнительно NН2- группу и образуют равновесные системы из 4-х форм:
Аминокислоты – амфолиты:
2. Нуклеофильные и электрофильные свойства аминокислот.
б) Реакции по карбоксильной группе
в) Реакции по другим группам: - гидроксилирования – введение в боковой радикал аминокислоты гидроксильной группы.
- окисления SH-связей - карбоксилирования – введение карбоксильной группы
- иодирования – введение атомов иода с образованием иодтиронинов – гормонов щитовидной железы:
3. Качественные реакции аминокислот. а) Реакция с нингидрином:
б) Биуретовая реакция
в) Ксантопротеиновая реакция (на Phe, Tyr, Trp, His):
г) реакция на серусодержащие аминокислоты:
4. Образование пептидов:
Аланилвалилфенилаланин (Ala-Val-Phe)
Синтез пептидов осуществляют в несколько стадий:
- защита NH2-группы в первой аминокислоте алкилированием - защита СООН-группы во второй аминокислоте этерификацией - активация СООН-группы в первой фосфорилированием - синтез пептида - снятие защитных групп
Иначе возможно образование смесей пептидов. Например:
Из 3 разных аминокислот получается трипептидов из 4 разных аминокислот – тетрапептидов из 20 разных аминокислот – полипептидов Установление аминокислотного состава белка.
1. Динитрофенилирование (метод Ф. Сенгера):
2. Метод Эдмана:
3. Дансильный метод:
Гидролиз белков
Строение белка. Первичная структура пептидов и белков — это
Вторичная структура белка — это более высокий уровень структурной организации, в котором закрепление конформации происходит за счет Третичная структура белка — это
Четвертичная структура белка — это
Тема: Углеводы
Классификация на основе продуктов окисления: 1. Моносахариды 2. Олигосахариды 3. Полисахариды 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|





















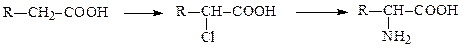

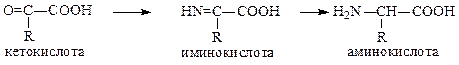







 а) Реакции по аминогруппе
а) Реакции по аминогруппе