|
|
Оценка величины зон ишемии и некрозаПротивоишемический эффект различных методов обезболивания оценивался на основании суточного мониторирования ЭКГ с помощью многофункционального монитора Life Scope 9 фирмы «Niсhon Kohden» (Япония). Потенциалы задней стенки левого желудочка (ЛЖ) регистрировали в биполярном отведении 111 (aVF), переднюю – V2-V4, анализ ЭКГ проводили при поступлении, через 15, 30, 60 минут, далее через 3, 6, 12, 24 часа первых суток острого периода ИМ. Противоишемический эффект считался положительным при снижении сегмента S-T относительно изолинии на 30% от исходного уровня. Кроме того, на вторые сутки заболевания 27 больным контрольной и 30 больным основной группы изучение противоишемического эффекта различных методов обезболивания проводили с помощью ЭхоКГ в М- и В- режимах до обезболивания и через 30 минут традиционного или эпидурального обезболивания. Изучалось изменение локальной (сегментарной) сократимости пораженного участка миокарда. У больных основной группы перед исследованием за 3 часа прекращалась эпидуральная инфузия наропина. Оценку динамики ишемического повреждения и формирования очага некроза миокарда мы проводили у 40 больных основной и 44 больных контрольной групп с передней локализацией ИМ, используя электрофизиологический (прекардиальное картографирование ЭКГ в 65 отведениях – ЭКТГ) и биохимический (серийное определение МВ КФК) методы исследования. ЭКТГ проводили на автоматизированной установке “Ритм-М”, которая производила компьютерную обработку показателей периинфарктной зоны и вычисление массы некроза в реальном масштабе времени по А.В.Виноградову и Г.П.Арутюнову, 1988. Изучались показатели размера очага некроза, степени повреждения и ишемии. ЭКТГ проводилось при поступлении, в конце 1, 2, 3, 5, 10, 25 суток ИМ. Активность МВ-КФК измеряли кинетическим методом на биохимическом анализаторе “Synchron” фирмы “Beсkman” (США). На основании изменения динамики активности МВ-КФК судили о скорости некротизации и времени стабилизации очага некроза миокарда. Исследования проводили при поступлении, каждые 4 ч в 1-е и 2-е сутки, через 6 ч на 3 – 4-е сутки, далее через 12 часов на 5 – 7 сутки заболевания. Статистические методы Статистическая обработка полученных результатов проводилась с использованием пакета Statistiсa v. 6.0 (StatSoft) и Microsoft Excel. Оценка средних значений дается в виде среднего арифметического М±m, где m – ошибка среднего значения. Для анализа вида распределения применялся критерий Колмогорова-Смирнова и Шапиро-Уилка. Для проверки гипотезы о равенстве средних при нормальном распределении использовали t критерий Стьюдента, при ненормальном распределении – критерий Манна-Уитни. Для исследования связей между количественными признаками рассчитывали коэффициенты корреляции Пирсона и ранговой корреляции Спирмена. Оценку различия частоты проводили с помощью критерия РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ 1. ФОРМИРОВАНИЕ ЭМОЦИОНАЛЬНО-БОЛЕВОГО СИНДРОМА У БОЛЬНЫХ В ОСТРОМ ПЕРИОДЕ ИНФАРКТА МИОКАРДА ПРИРАЗЛИЧНЫХ МЕТОДАХ ОБЕЗБОЛИВАНИЯ При поступлении эмоционально-болевой синдром наблюдался у всех обследованных, оценивался по следующимпараметрам: характеру, выраженности, распространенности. ЭБС значительно не различался у больных в группе сравнения и основной (табл. 3). У больных обеих групп в большинстве случаев (69,6% и 67,7% соответственно) доминировал выраженный болевой синдром с оценкой более 3 баллов.
Таблица 3 Динамика клинических проявлений болевого синдрома у больных ИМ при различных методах обезболивания (М±m)
Продолжение табл. 3
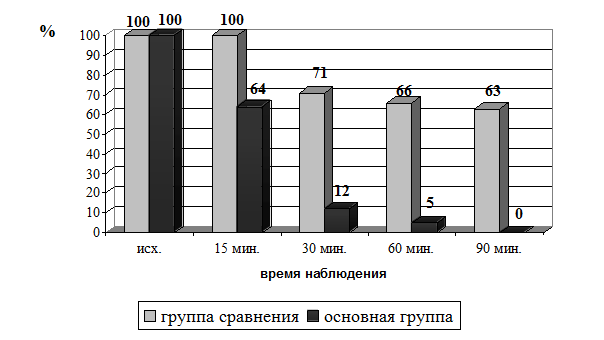
Введение эпидурально морфина и наропина привело через 15 минут к полному купированию болевого синдрома у 35 (36,4%) больных (р<0,001), а через 30 минут боли купировались у 92 (95,9%) больных. Через час у них исчезло чувство страха, беспокойства, развилась седация. Только у 4 пациентов (4,1%) сохранились незначительные болезненные ощущения за грудиной, которые прошли после дополнительного эпидурального введения 2-4 мл наропина. Через 90 минут наблюдения боли полностью купировались у всех больных основной группы (рис. 1).
Рис.1. Количество больных (%) с ЭБС в первые 1,5 часа наблюдения больных группы сравнения и основной группы.
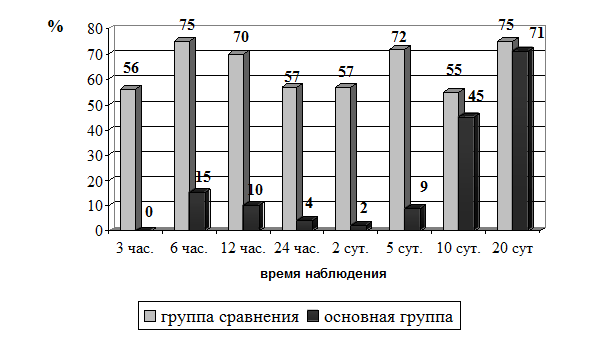
После внутривенного введения морфина в дозе 10 мг ангинозный статус полностью купировался через 30 - 60 минут только в 32,3% - 35,7% случаев (р<0,05). У 72 больных (64,2%) сохранялся болевой синдром выраженностью в 2,48±0,15 балла. Ввиду интенсивности болей у 43 больных (38,4%) этой группы повторно внутривенно вводился морфин в дозе 10 мг. В последующие часы наблюдения (рис. 2) у больных основной группы рецидивирование болей слабой интенсивности отмечено в 9,6% случаев. У 69 (61,6%) больных группы сравнения в первые 12 часов, несмотря на неоднократное введение наркотических средств и подключения инфузии нитроглицерина, сохранялся или рецидивировал болевой синдром.
Рис. 2. Случаи сохранения болевого синдрома в последующие часы и сутки ИМ у больных группы сравнения и основной группы (%). Как видно из полученных результатов оценки клинических проявлений ЭБС, комбинированная ЭА уже в первые 15-30 минут у большинства больных (64 -70%) полностью купирует болевой синдром, тогда как у больных с традиционным обезболиванием только в 28,7% случаев достигается полное купирование болей. В течение первых суток наркотики введены каждому больному группы сравнения от 2 до 6 раз (в среднем 3,8 раза). В основной группе суточная доза наркотических препаратов составила существенной меньшие значения. Частые рецидивы ангинозных приступов у больных группы сравнения привели к стойкому формированию психоневротических расстройств (кардиофобия, депрессивный и ипохондрический синдром) в 37,6% случаев. Степень ноцицептивной защиты различных методов обезболивания также оценивалась на основании гормональных нарушений, которые участвуют в механизмах формирования стресс-реакции. Динамика изменения концентрации кортизола в крови на фоне традиционного и эпидурального обезболивания, представлены в таблице 4. Таблица 4 Динамика изменения содержания в крови кортизола (нмоль/л) у больных ИМ при различных методах обезболивания (М±m)
Референтные значения: кортизол – 508±86,7 нмоль/л. На фоне эпидурального обезболивания уже через 2 часа, по сравнению с традиционным обезболиванием, происходит достоверно меньшее повышение содержания в плазме крови кортизола на 25,4% (р<0,01), что свидетельствует о быстром снижении реакции тревоги эмоционально-болевого стресса. У больных группы сравнения на фоне сохранения или рецидивирования болевого синдрома, значительное снижение уровня кортизола наблюдалось только на 2-е сутки острого периода ИМ. Пролонгированная методика ЭА в первые 3-х суток способствовала сохранению более низкого уровня концентрации кортизола, по сравнению с обезболиванием по требованию среднем на 24,8%. Результаты наших исследований доказывают стресс-лимитирующий эффект длительной морфинно-наропиновой эпидуральной аналгезии у больных в остром периоде ИМ. При поступлении выраженный эмоционально-болевой синдром сопровождался значительным повышением концентрации пролактина в крови, который при поступлении у больных с традиционным и эпидуральным обезболиванием составил соответственно 1135±89,1 и 1086±72,6 мкМЕ/мл (табл. 5). На фоне эффективного и длительного эпидурального обезболивания, обладающего симпатолитическим действием, наблюдалось значительное снижение концентрации пролактина после обезболивания и в последующие сутки, по сравнению с больными, которым неоднократно с целью обезболивания вводились наркотические средства. На высоте обезболивающего эффекта и в последующие сутки, по сравнению с группой сравнения, происходило достоверное снижение концентрации пролактина на 32,7-35,9%. Таблица 5 Динамика изменения содержания в крови пролактина (МкЕд/мл) у больных ИМ при различных методах обезболивания (М±m)
Референтные значения: пролактин – 436,8±32,5 МкЕд/мл. В реализации механизмов стресс-реакции у больных ИМ важную роль играют метаболические эффекты инсулина, соматотропного гормона (СТГ). При стрессе эти гормоны обладают анаболическим действием (Шрейбер В., 1987). В эксперименте при развитии ИМ эти гормоны способствуют ускорению репаративных процессов в миокарде (Данилявичюс Ю. С., 1981). Из данных видно, что купирование ЭБС с помощью комбинированной ЭА способствовало уже через 2 часа увеличению СТГ, в 1,7 раз от исходного уровня. Значительное повышение СТГ у больных основной группы сохранялось на протяжении первых 2-х суток эпидуральной аналгезии, при этом происходило одновременное снижение содержания кортизола в плазме крови на 29,2% (р<0,001), что свидетельствует об эффективной антиноцицептивной защите и стресс-лимитирующим эффекте эпидурального обезболивания по сравнению с традиционным обезболиванием. У больных основной группы отмечалась отчетливая тенденция к увеличению концентрации инсулина (на 21,1% - 24,5%, р<0,05) в первые сутки заболевания относительно больных группы сравнения, где в большинстве случаев рецидивировал болевой синдром. На 10 сутки ИМ достоверных различий в концентрации инсулина, СТГ, кортизола и пролактина у больных группы сравнения и основной групп не наблюдалось. У больных группы сравнения после неоднократного введения наркотических средств внутривенно в 17,6% случаев наблюдалось появление таких грозных осложнений, как угнетение дыхания и кровообращения. В 25% случаев развилась выраженная гипотензия, которая требовала введения плазмозамещающих растворов, а 8 больным (29,6%) проводилась инфузия дофамина в режиме инотропной поддержки. У больных основной группы отстроченной депрессии дыхания не наблюдалось ни в одном случае, и только у 6 (5,7%) больных с инфарктом задней локализации развилась умеренная гипотензия (снижение АД ст. до 90 - 85 мм рт. ст.), которая быстро купировалась внутривенным введением плазмозамещающих растворов. На фоне эпидуральной аналгезии у меньшего количества больных, по сравнению с традиционным обезболиванием, наблюдалась задержка мочи (20,2% и 14,8% соответственно). У 12 больных (11,5%) в первые сутки эпидурального обезболивания наблюдался кожный зуд, который эффективно купировался внутривенным введением нейролептиков (дроперидол) в малых дозах. Эти незначительные осложнения при эпидуральном обезболивании наркотическими анальгетиками общеизвестны и согласуются с литературными данными. Таким образом, обезболивание методом длительной морфинно-наропиновой ЭА значительно эффективнее, чем внутривенное обезболивание наркотическими препаратами. Благодаря комбинированному действию на различные звенья нейрональной системы спинного и головного мозга, в виде активации опиоидной системы и фармакологической блокады корешков, достигается эффективная антиноцицептивная защита миокарда, что важно в период формирования инфаркта миокарда в остром периоде заболевания. Осложнения, сопутствующие традиционному обезболиванию, наблюдаются значительно реже и менее выражены при торакальной эпидуральной анальгезии. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 .Для анализа оценки болевого синдрома использовали дискриминантный анализ с вычислением линейной дискриминантной функции. Различие полученных результатов рассматривалось статистически значимым при р<0,05. Для оценки эффективности ТЭА использовалась система CONSORT.
.Для анализа оценки болевого синдрома использовали дискриминантный анализ с вычислением линейной дискриминантной функции. Различие полученных результатов рассматривалось статистически значимым при р<0,05. Для оценки эффективности ТЭА использовалась система CONSORT.