
|
|
Четвертая аналитическая группа катионовКо второй аналитической группе относятся: Аl3+, Сr3+, Zn2+, Аs (III), Аs (V). Цвет ионов в растворе: ионы алюминия и цинка, ионы хрома (III) окрашены в зеленый или фиолетовый цвет. Отношение к воде солей, содержащие данные ионы: хорошо растворимы сульфаты, нитраты, галогениды алюминия, цинка, хрома. Основания: гидроксиды катионов 4 группы труднорастворимые, слабые электролиты, проявляет амфотерные свойства. Отношение к гидролизу:все соли гидролизуются, соли слабых кислот подвергаются необратимому гидролизу. Комплексообразование: ионы алюминия, хрома, цинка. Токсичность: все соли мышьяка. Применение в фармации:Гидроксид алюминия – адсорбирующее действие. Алюмокаливые квасцы – как кровоостанавливающее средство и для прижигания. Сульфат цинка – в виде глазных капель. Оксид цинка - в составе мазей для лечения кожных заболеваний. Соединения мышьяка в составе многих ЛП, Оксид мышьяка (III) – в стоматологической практике. Групповой реагент: гидроксид натрия в избытке. При избытке группового реагента все образуют комплексные соединения.
Частные реакции катионов 4 аналитической группы. Реакции катиона алюминия. 1. Едкие щелочи – групповой реагент.
Белый осадок Примечание: Осадок растворим в избытке реагента. Аl(ОН)3 + КОН К[Аl(ОН)4]
К[Аl(ОН)4] Белый осадок Примечание: Осадок как амфотерный растворим в минеральных и уксусной кислотах и в избытке щелочи. 2.
Белый осадок Примечание: Осадок растворим в щелочах. 3. Ализарин 1, 2-диоксиантрахион. Реакция очень чувствительная. Аналитический эффект: ярко-красное окрашивание «алюминиевый лак»
Примечание: Ионы хрома и цинка мешают определению. Реакцию можно проводить полумикрометодом или капельным методом. 4. Нитрат кобальта – получение «тенаровой сини».
Зола синего цвета Примечание: Реакцию проводят на фильтровальной бумаге, которую затем сжигают.
Реакции катиона хрома (III). 1. Едкие щелочи – групповой реагент.
Серо-зеленый аморфный осадок Примечание: Осадок растворим в избытке реагента и разбавленных кислотах. Сr(ОН)3 + 3КОН К3[Сr(ОН)6] 2.
Серо-зеленый аморфный осадок Примечание: Осадок растворим в щелочах. 3. Окислители: Пероксид водорода, хлор, перманганат калия. В присутствии щелочи образуются хроматы желтого цвета, в кислой среде – дихроматы оранжевого цвета.
Ярко-желтый раствор Примечание: При подкисливании полученного раствора серной кислотой, образуется надхромовая кислота синего цвета, легко переходящую в эфирный слой.
Реакции катиона цинка 1. Едкие щелочи – групповой реагент.
Белый студинистый осадок Примечание: Осадок растворим в избытке реагента и разбавленных кислотах.
2. Гексацианоферрат (II) калия (желтая кровяная соль). Реакция фармакопейная.
Белый осадок 3. Гексацианоферрат (III) калия (красная кровяная соль).
Коричневато-желтый осадок Примечание: Осадок растворяется в соляной кислоте и растворе аммиака. 4.
Белый аморфный осадок 5. Нитрат кобальта – получение «зелени Ринмана».
Зола зеленого цвета Примечание: Реакцию проводят на фильтровальной бумаге, которую затем сжигают. Ионы алюминия и хрома мешают проведению реакции. 6. Тетрароданомеркурат (II) аммония – микрокристаллоскопическая реакция.
Бесцветные кристаллы в виде крестов или дендритов, клиньев.
Реакции ионов мышьяка (III) Соединения мышьяка (III) находятся в растворах в виде арсенит-анионов АsО33- 1. Нитрат серебра. Реакция фармакопейная. Nа3АsО3 + АgNО3 Аg3АsО3 + ….. Желтый осадок Примечание: Осадок растворим в азотной, уксусной кислотах, растворе аммиака. Раствор иода
Обесцвечивание раствора иода Примечание: Реакция проводится в нейтральной и слабощелочной среде. Чтобы реакция была необратимой, добавляют гидрокарбонат натрия. 3. Сульфид натрия. Реакция фармакопейная. 2Nа3АsО3 + 3Nа2S + 12НСl Аs2S3 + 12NаСl + 6Н2О Ярко-желтый осадок Примечание: Реакцию проводят в кислой среде. Осадок растворяется в концентрированной азотной кислоте, полисульфиде аммония, в щелочах, в карбонатах щелочных металлов. Реакции ионов мышьяка (V) Соединения мышьяка (V) находятся в растворах в виде арсенат-анионов АsО43- 1. Нитрат серебра. Реакция фармакопейная.
Шоколадного цвета осадок Примечание: Осадок растворим в азотной, растворе аммиака. 2.
Раствор желтого цвета Примечание: Реакция проводится в кислой среде. При добавлении хлороформа, хлороформный слой окрашивается в малиновый цвет 3.
желтый осадок Примечание: Реакцию проводят в кислой среде. Осадок растворяется в полисульфиде аммония, в щелочах, в карбонатах щелочных металлов, в избытке сульфида натрия. 4.
Арсенат магния-аммония Белый кристаллический осадок Примечание: Реакция позволяет отделить соли мышьяка (V) от солей мышьяка (III).
Анализ смеси катионов четвертой аналитической группы. 1. Действие группового реактива.Реагент – гидроксид натрия по каплямдо появления осадка, а потом до его полного растворения. Добавить пероксид водорода и нагревают до прекращения выделения газа. Желтый цвет раствора указывает на ионы хрома. 2. Испытание на катионы алюминия. Переведение иона алюминия в осадок – добавление сухого хлорида аммония и нагревают. Проверочная реакция на алюминий – к осадку добавляют соляную кислоту, раствор аммиака и раствор ализарина. 3. Испытание на присутствие катионов хрома (III).К раствору добавляют серную кислоту, пероксид водорода и 1 мл эфира – синяя окраска эфирного слоя. 4. Испытание на присутствие катионов цинка.К раствору, после отделения алюминия, прибавляют сульфид натрия – белый осадок. Схема учебника стр. 183 Домашнее задание. Стр. 164-184, стр. 155 За 9.02.2016 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|


 2АlСl3 + 3(NН4)2S + 6Н2О 2Аl(ОН)3 + 3Н2S + 6NН4Сl
2АlСl3 + 3(NН4)2S + 6Н2О 2Аl(ОН)3 + 3Н2S + 6NН4Сl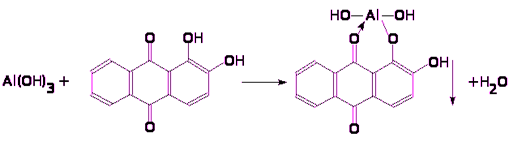
 2СrСl3 + 3Н2О2 + 10КОН 2К2СrО4 + 6КСl + 8Н2О
2СrСl3 + 3Н2О2 + 10КОН 2К2СrО4 + 6КСl + 8Н2О
 3ZnСl2 + 2К4[Fе(СN)6] Zn3К2[Fе(СN)6]2 + 6КСl
3ZnСl2 + 2К4[Fе(СN)6] Zn3К2[Fе(СN)6]2 + 6КСl 3ZnСl2 + 2К3[Fе(СN)6] Zn3[Fе(СN)6]2 + 6КСl
3ZnСl2 + 2К3[Fе(СN)6] Zn3[Fе(СN)6]2 + 6КСl ZnСl2 + (NН4)2S ZnS + …..
ZnСl2 + (NН4)2S ZnS + ….. Nа3АsО3 + I2 + Н2О Nа3АsО3 + 2НI
Nа3АsО3 + I2 + Н2О Nа3АsО3 + 2НI