
|
|
Получение клеточной суспензии из лимфатических узлов, тимуса и селезенкиЛимфатические узлы (подмышечные, паховые, брыжеечные и др.), тимус или селезенку очищают от жира и соединительной ткани. Очищенные лимфатические узлы, тимус или селезенку переносят в чашку Петри или бюкс с небольшим количеством среды 199 (0,5 мл) и фрагментируют ножницами (можно осторожно ворсить скальпелем, разрывать препаровальными иглами или раздавливать в гомогенизаторе) до получения однородной клеточной взвеси. К полученной взвеси добавляют еще 2,5 мл среды 199 и фильтруют ее через капроновую сетку в центрифужную пробирку. Дважды отмывают средой 199 при центрифугировании в течение 5 мин при 1000 об/мин. Супернатант удаляют, а к осадку добавляют свежей среды 199 и ресуспензируют пастеровской пипеткой, шприцем с иглой или автоматическим дозатором. В полученной клеточной суспензии подсчитывают число ядросодержащих клеток в 1 мл и определяют их жизнеспособность (см. ниже). Подсчет числа ядросодержащих клеток в суспензии Взвесь клеток тщательно перемешивают шприцем с иглой или автоматическим дозатором. В лунке круглодонного планшета смешивают 20 мкл взвеси клеток и 180 мкл 5% раствора уксусной кислоты. Таким образом, первоначальная взвесь клеток разводится в 10 раз (эритроциты под влиянием уксусной кислоты лизируются, у ядросодержащих клеток разрушается оболочка, но ядра сохраняются). Полученную смесь опять тщательно перемешивают и затем заполняют ею камеру Горяева. Под микроскопом в сетке камеры Горяева подсчитывают число клеток в 100 больших квадратах (25 «окон»). Подсчет производят в 2 сетках камеры и выводят среднее число клеток. Принцип подсчета числа клеток в 1 мл суспензии Полученное число клеток соответствует объему в 100 больших квадратах, т.е. 0,4 мм3 (площадь квадрата 1/25 мм2, высота камеры 0,1 мм). Следовательно, если в камере насчитали 100 клеток, т.е. в 0,4 мм3 находится 100 клеток, то в 1000 мм3 - 250 000 клеток, а с учетом разведения клеток в 10 раз общее число ядросодержащих клеток в 1 мл составит 50х106. По упрощенной схеме подсчета полученное среднее число клеток делят на 4 и умножают на 105. Для определения общего числа ядросодержащих клеток в органе количество клеток в 1 мл умножают на количество среды, в которой был суспензирован орган или ткань. Х = А / 4 × 105, где Х - количество клеток в 1 мл клеточной суспензии; А - количество клеток в 25 квадратах. Для определения общего числа ядросодержащих клеток в органе количество клеток в 1 мл умножают на количество среды, в которой были суспендированы орган или ткань. Определение жизнеспособности клеток Определение жизнеспособности клеток производится методом суправитальной окраски 0,1% раствором трипановой сини. Hа предметное стекло наносят каплю взвеси клеток и 1 каплю 0,1% раствора трипановой сини. Через 30-60 с окрашенную каплю взвеси покрывают покровным стеклом. Избыток суспензии удаляют промакиванием фильтровальной бумагой и под микроскопом подсчитывают число живых (неокрашенных) и погибших (синих) клеток на 100 кариоцитов. Выводят процент гибели клеток. Раствор трипановой сини готовят заранее. Порошок растворяют в бидистиллированной воде из расчета получения 0,2% раствора, который фильтруют. Это маточный раствор. Рабочий раствор приготовляют перед опытом: маточный раствор разбавляют 4,25% раствором хлористого натрия до нужной концентрации (1 капля гипотонического физиологического раствора + 3 капли трипановой сини). Вопросы и задания 1. Дайте определение инбредных животных. 2. Опишите принцип получения конгенных линий мышей. 3. Какие биологические материалы используются для исследования иммунной системы? 4. Перечислите основные этапы получения клеток костного мозга у мышей. 5. Перечислите основные этапы выделения клеток из периферических органов мышей. 6. Как подсчитать количество клеток в 1 мл клеточной суспензии и определить жизнеспособность клеток? Глава 2 Методы разделения клеток периферической крови человека Для изучения функциональной активности лимфоцитов и других клеток крови необходимы эффективные способы их разделения (рис. 2.1). Идеальные методы разделения характеризуются незначительной степенью потерь клеток при высокой степени очистки, сохранением физиологической активности выделенных клеток. В основе методов выделения клеток лежат два главных принципа. 1. Разделение клеток по их физическим свойствам, например по размерам, плотности или заряду. 2. Разделение клеток по поверхностным антигенам.
Среди разнообразных способов разделения клеток крови наибольшее распространение получили гравитационные, основанные на различной удельной плотности клеток крови, которые различаются между собой следующим образом: эритроциты > нейтрофилы и эозинофилы > лимфоциты и моноциты > тромбоциты. ВЫДЕЛЕНИЕ ЛЕЙКОЦИТОВ Принцип метода.Для осаждения эритроцитов из периферической крови применяют растворы декстрана, желатины и др. Гепаринизированную кровь смешивают с 6% раствором декстрана или 0,3% раствором желатины в соотношении 1:5. Смесь в пробирке отстаивают 30-40 мин под углом 45° в термостате при температуре 37 °С до осаждения эритроцитов. Плазму, обогащенную лейкоцитами, отбирают, примесь эритроцитов лизируют. Выделенные клетки отмывают центрифугированием в растворе Хенкса или культуральной среде 199 при 1000 об/мин в течение 5 мин. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
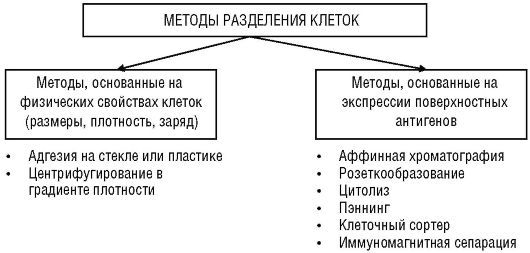 Рис. 2.1.Основные методы разделения клеток
Рис. 2.1.Основные методы разделения клеток