
|
|
Ингибиторный иммуноферментный анализВ ингибиторном ИФА (рис. 4.6) на твердой фазе иммобилизуют антиген. Растворимые антитела как реагент конъюгированы с ферментом. Определяемый антиген в испытуемой пробе конкурирует с иммобилизованным на твердой фазе антигеном за растворимые антитела. В итоге ферментативная активность, измеряемая на твердой фазе, обратно пропорциональнаконцентрации определяемого вещества в пробе. Результаты ИФА показаны на рис. 4.7 (см. также цв. вклейку).
«Сэндвич»-ИФА «Сэндвич»-ИФА (рис. 4.8) разработан для антигенов, на которых есть не менее двух неперекрывающихся эпитопов. Против обоих эпитопов получают в качестве реагентов специфичные антитела. Антитела к одному из эпитопов сорбируют на твердой фазе. Испытуемую пробу добавляют к твердой фазе, инкубируют, отмывают. После отмывки вносят конъюгат антител ко второму эпитопу с ферментом. Ферментативная активность, остающаяся на твердой фазе, прямо пропорциональнасодержанию антигена в пробе. «Сэндвич»-ИФА не требует препаратов очищенных антигенов, что выгодно отличает его от конкурентных и ингибиторных методик, поскольку чистые антигены всегда труднодоступны и дороги. Чувствительность «сэндвич»-ИФА потенциально выше, чем конку-
рентных и ингибиторных. Аналогичная технология применима и с использованием одного антитела (и на твердой фазе, и в составе конъюгата с ферментом) в случаях наличия на заданном антигене повторяющихся эпитопов. В современных модификациях ту же технологию называют ловушечным ИФА (capture IA) - антитела на твердой фазе «ловят» свой антиген из смеси веществ в биопробе.
Иммунометрический анализ При иммунометрическом анализе (рис. 4.9) в пробирку с испытуемой пробой, предположительно содержащей определяемый антиген, вносят заведомый избыток меченых антител. Затем к этой смеси добавляют также заведомый избыток иммобилизованного на мелкодисперсной твердой фазе антигена. После инкубации центрифугированием отделяют растворимую фракцию (супернатант) и в ней измеряют ферментативную активность (если метка - фермент). Ферментативная активность супернатанта прямо пропорциональна содержанию антигена в испытуемой биопробе. Благодаря использованию избытка реагентов этот метод более чувствителен, чем конкурентный ИФА, и его аналитические возможности приближаются к предельным.
Непрямые иммуноанализы Непрямые методики (рис. 4.10) применяют чаще, чем прямые. Непрямым иммуноанализом называют анализ, в котором метку присоединяют не к целевому антигену и не к антителу против целевого антигена, а к так называемым вторым антителам - антивидовым антииммуноглобулиновым антителам, т.е. антителам к иммуноглобулинам того вида животных или человека, с биологическим материалом которого работают.
Таким образом, один и тот же препарат конъюгата антиглобулиновых антител с ферментом используют в качестве проявляющего стандартного реагента в разных тест-системах для определения различных конкретных антигенов или антител. Вместо антивидовых антиглобулиновых антител для конъюгации с ферментом может быть использован, например, протеин А стафилококка, который по своей природе с высокой аффинностью связывается с иммуноглобулинами класса G некоторых видов млекопитающих, включая человека. Все описанные схемы постановки прямого варианта ИФА (конкурентный, ингибиторный, «сэндвич», иммунометрический) применяют и в непрямом варианте. Непрямые варианты ИФА не требуют очистки искомых антигенов или антител. Чистым должен быть только препарат антивидовых антииммуноглобулиновых антител. В качестве ферментов-меток в ИФА используются следующие ферменты и субстраты для них. 1. Пероксидаза из корней хрена, субстраты: • орто-фенилендиамин (продукт желто-коричневый, растворимый, поглощает при 492 нм); • 3,3'-диаминобензидин (продукт коричневый, нерастворимый); • 3-амино-9-этилкарбазол (продукт красный; нерастворимый); • 5-аминосалициловая кислота (продукт коричневый, растворимый, поглощает при 405 нм); • 2,2'-азино-бис(3-этилбензтиазолин)-6-сульфоновая кислота (продукт зеленый, растворимый, поглощает при 405 нм); • 4-хлоро-1-нафтол(продуктголубой,нерастворим);3,3'-диметокси- бензидин (продукт желто-оранжевый, растворимый, поглощает при 405 нм); • 3,3',5,5'-тетраметилбензидин (продукт голубой, растворимый, поглощает при 450 нм); • ABTS - 2,2'-азино-ди(3-этилбензтиазолин)-6-сульфоновая кислота. 2. β-Галактозидаза (субстраты - дериваты β-галактозида, например 4-метилумбелиферил-β-D-галактозин). 3. Щелочная фосфатаза (субстраты: 5-бромо-4-хлоро-3-индолил фосфат в комбинации с голубым тетразолиевым, продукт голубой, нерастворимый; р-нитрофенил фосфат, продукт желтый, растворимый, поглощает при 405 нм). 4. Уреаза(субстрат - мочевина в комбинации с бромкрезолом пурпурным, продукт образуется очень быстро, пурпурного цвета, растворимый, поглощает при 590 нм). Нерастворимые продукты ферментативных реакций используют в методах иммуногистохимии и иммуноблота, растворимые - в иммуноферментных анализах, в которых результат регистрируют количественно спектрофотометрически. Встречаются оригинальные разработки с использованием других (кроме вышеперечисленных) ферментов-меток. Если по тем или иным биохимическим причинам заданный антиген или интересующее антитело не удается конъюгировать с меткой без существенных потерь в аффинности их связывания, то в конструкцию тест-системы пробуют вводить дополнительные компоненты. Например, нередко используют так называемое «авидинбиотиновое» взаимодействие. Авидин - белок, выделяемый из «белка» куриных яиц, биотин - витамин Н (он же кофермент R). Авидин по своей природе с высокой аффинностью (Kd ~ 10-15 M) связывает биотин. Биотин легко конъюгируется с флюоресцеином. Кроме того, и против авидина, и против биотина получены высокоаффинные моноклональные антитела (существуют коммерческие препараты). Соответственно все эти дополнительные компоненты используют при необходимости в конструкциях тест-систем, предназначенных для детекции того или иного заданного вещества. Сходным по аффинности сродством к биотину обладает также белок стрептавидин, выделяемый из грибов Streptomyces avidinii. В конкретных вариантах тест-систем используют разные буферные растворы, соответствующие свойствам конкретных антигенов, ферментов и их субстратов. Для примера мы опишем последовательность действий и используемые реагенты при выполнении непрямого твердофазного иммуноанализа, его простой и часто встречающийся вариант, подходящий, в частности, для определения специфических противовирусных антител как маркера наличия в организме той или иной вирусной инфекции (специфическую лабораторную диагностику вирусных инфекций применяют для выявления инфицированности ВИЧ, вирусами гепатитов, герпеса, цитомегаловирусами и др.). Лабораторная работа 4-2 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
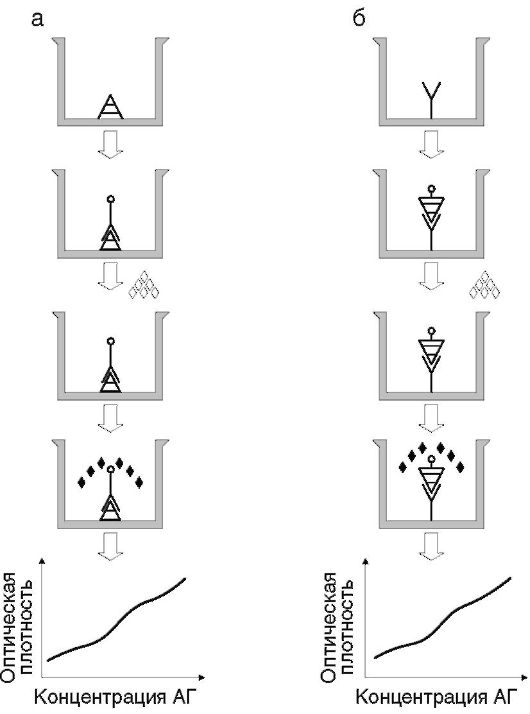 Рис. 4.5.Схема постановки прямого метода ИФА: а - для выявления антител; б - для выявления антигена; АГ - антигены; АТ - антитела.
Рис. 4.5.Схема постановки прямого метода ИФА: а - для выявления антител; б - для выявления антигена; АГ - антигены; АТ - антитела. Рис. 4.6.Принцип конкурентного (а) и ингибиторного (б) ИФА
Рис. 4.6.Принцип конкурентного (а) и ингибиторного (б) ИФА Рис. 4.7.Планшет с результатами ИФА
Рис. 4.7.Планшет с результатами ИФА Рис. 4.8.Принцип «сэндвич»-ИФА
Рис. 4.8.Принцип «сэндвич»-ИФА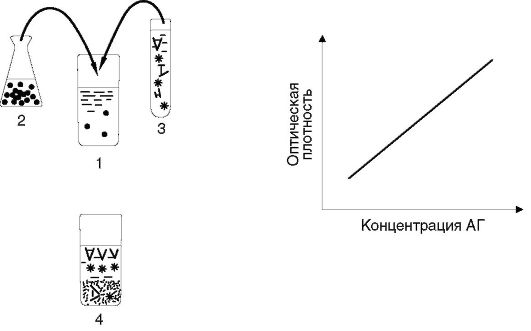 Рис. 4.9.Принцип иммунометрических анализов: 1 - пробирка с биопробой (сывороткой крови или др.); 2 - в пробирку с биопробой вносят заведомый избыток чистого антигена, сорбированного на мелкодисперсном твердофазном носителе; 3 - затем в ту же пробирку вносят заведомый избыток меченых антител; 4 - материал инкубируют (чтобы реагенты успели связаться), центрифугируют и в супернатанте измеряют количество метки. Величина сигнала в супернатанте прямо пропорциональна содержанию искомого вещества (антигена) в испытуемой пробе. OD - optical density - величина оптической плотности, измеренная спектрофотометром; АГ - концентрация искомого антигена в биопробах
Рис. 4.9.Принцип иммунометрических анализов: 1 - пробирка с биопробой (сывороткой крови или др.); 2 - в пробирку с биопробой вносят заведомый избыток чистого антигена, сорбированного на мелкодисперсном твердофазном носителе; 3 - затем в ту же пробирку вносят заведомый избыток меченых антител; 4 - материал инкубируют (чтобы реагенты успели связаться), центрифугируют и в супернатанте измеряют количество метки. Величина сигнала в супернатанте прямо пропорциональна содержанию искомого вещества (антигена) в испытуемой пробе. OD - optical density - величина оптической плотности, измеренная спектрофотометром; АГ - концентрация искомого антигена в биопробах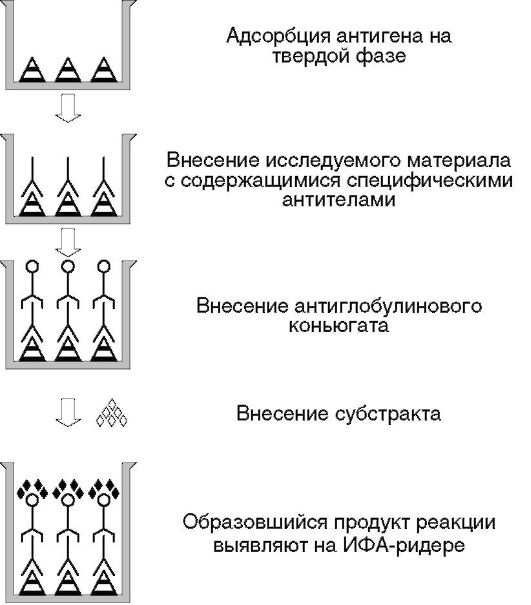 Рис. 4.10.Принцип непрямых иммуноанализов
Рис. 4.10.Принцип непрямых иммуноанализов