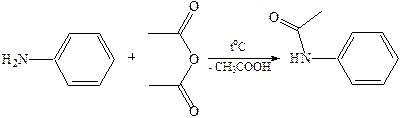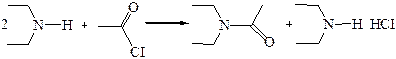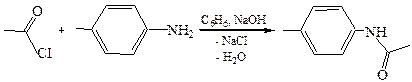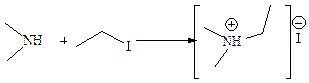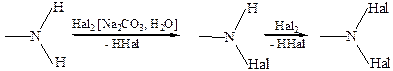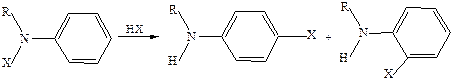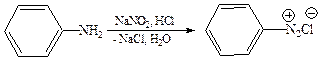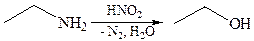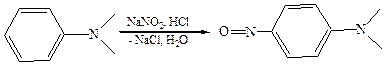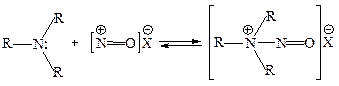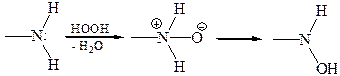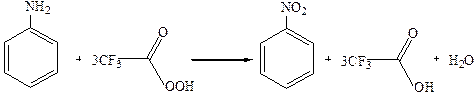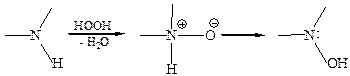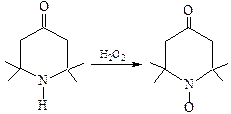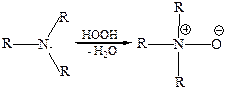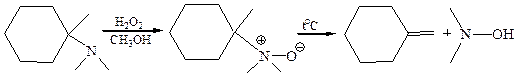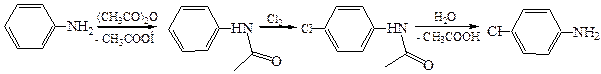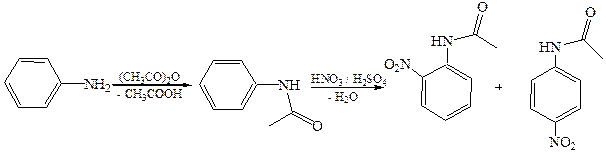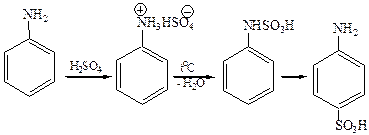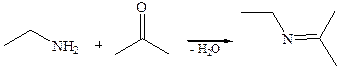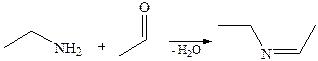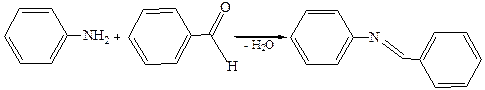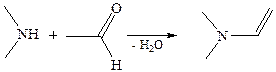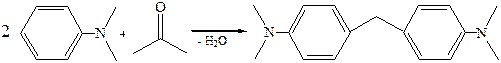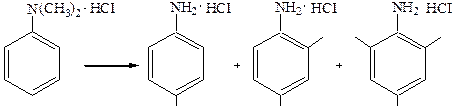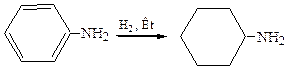|
|
Химические свойства аминов1. Реакция ацилирования. Реакция протекает как АNu – ENu по карбонильной группе. Первичные и вторичные амины гладко реагируют с галогенангидридами и ангидридами кислот с образованием амидов кислот, третичные амины в эту реакцию не вступают:
При использовании галогенангидридов, выделяющийся галогеноводород связывается избытком амина или добавленым щелочным агентом:
Первичные и вторичные амины легко подвергаются ацилированию и при взаимодействии с алкил- и арилсульфохлоридами:
1.1 Ацилирование по методу Шотенна–Баумана. Реакцию осуществляют в присутствии концентрированного водного раствора NaOH, Na2CO3, NaHCO3, CH3COONa, MgO, CaO, BaO. Образование амида вместо возможного гидролиза ацилирующего агента в этих условиях объясняется тем, что ацилирование происходит в органической фазе (обычно в растворе углеводорода), а нейтрализация кислоты щелочью – в водной фазе:
2. Реакция алкилирования. Первичные, вторичные и третичные амины вступают в реакции с галогеналканами и спиртами. Эти реакции протекают как SN2:
При алкилировании третичных аминов получают четвертичные аммониевые соединения:
2.1 Образование N-галогенаминов. В слабощелочной среде первичные и вторичные амины образуют с галогенами N-галогенамины:
2.2 Реакция взаимодействия ариламинов с арилгалогенидами. Первичные и вторичные ариламины сравнительно легко реагируют с активированными арилгалогенидами по механизму SN2. Например, реакция анилина с 2,4-динитрохлорбензолом приводит к образованию динитродифениламина:
2.3 Перегруппировка Ортона (1901 г.).N-галогенариламины подвергаются перегруппировке с образованием п- и о-галогенариламинов:
Взаимодействие аминов с азотистой кислотой 3.1.1 Взаимодействие первичных ароматических аминов с азотистой кислотой приводит к образованию устойчивых солей диазония:
3.1.2 Взаимодействие первичных алкиламинов с азотистой кислотой:
3.2 Взаимодействия вторичных ароматических аминов и алкиламинов с азотистой кислотой. Вторичные амины при взаимодействии с азотистой кислотой образуют N-нитрозоамины. Нитрозирующим агентом выступает нитрозилхлорид. 3.2.1
Если ароматический нитрозоамин вводят в реакцию с раствором соляной кислоты в этиловом спирте, то нитрозогруппа мигрирует в пара-положение ароматического кольца. Эта реакция известна как перегруппировка Фишера–Хепа (1886 г):
3.2.2
3.3 Взаимодействие третичных ароматических аминов с азотистой кислотой. Реакция нитрозирования идет не по аминогруппе, а в ароматическое ядро как SE, в качестве продукта образуется С-нитрозосоединение:
3.3.1 Взаимодействие третичных алкиламинов с азотистой кислотой. Третичные алкиламины в сильнокислых средах практически не реагируют с азотистой кислотой, однако в слабокислых средах, когда аминогруппа не протонируется, третичные амины могут образовывать продукты присоединения:
4. Получение изоцианидов. При нагревании с небольшим количеством хлороформа и щелочи первичные амины превращаются в изоцианиды:
5. Взаимодействие с сероуглеродом. Первичные амины с сероуглеродом образуют N-замещенные дитиокарбаминовые кислоты, которые хлоридом ртути (II) переводятся в изотиоцианаты, а с избытком амина дают N,N-дизамещенные тиомочевины:
Для вторичных аминов реакция останавливается на стадии дитиокарбаминовых кислот:
Третичные амины не реагируют с сероуглеродом. 6. Реакция окисление аминов. Амины способны восстанавливать различные окислители, однако это свойство далеко не всегда практически реализуется, так как в ходе реакций окисления часто образуются сложные трудноразделимые смеси продуктов. В качестве окислителей применяют Н2О2, RCOOOH, КМПО4, МпО2, соли ртути, тетраацетат свинца и др. 6.1 Реакция окисления первичных и вторичных аминов. Для первичных и вторичных алкил- и ариламинов первоначальными продуктами окисления в мягких условиях являются N-оксиды аминов, которые перегруппировываются в производные гидроксиламина. 6.1.1 Реакция окисления первичных аминов:
6.1.2 Реакция окисления первичного ариламина гидропероксидом трифторацетила:
6.2 Реакция окисления вторичных аминов:
При окислении пространственно затрудненных вторичных аминов, например, триацетонамина, образуются иминоксильные радикалы, например, 2,2,6,6-тетраметил-4-оксопиперидин-1-оксил:
6.3 Реакция окисления третичных аминов. Третичные амины окисляются до оксидов аминов при применении пероксида водорода или пероксикарбоновых кислот:
6.3.1 Реакция Коупа (1949 г.). При нагревании до 150–200 оС оксиды третичных аминов подвергаются элиминированию при наличии хотя бы одного атома водорода у β-углеродного атома. Например, нагреванием N,N-диметилциклогексилметанаминооксида с количественным выходом получают метиленциклогексан:
6.3.2 Ацилирование третичных аминов:
7. Реакции с электрофильными реагентами ароматических аминов 7.1 Галогенирование. Активность анилина в реакциях галогенирования столь велика, что эти реакции не требуют применения катализатора, а замещение на галоген протекает сразу в три положения быстро и количественно:
7.1.1 Получение моногалогенаминов. Моногалогенамины получают галогенированием анилидов с последующим удалением ацильной группы гидролизом:
7.2Нитрование. Для снижения основных свойств анилина и предотвращения возможных окислительных процессов при получении n-нитроанилина проводят предварительную защиту аминогруппы ацилированием:
7.2.1Нитрование третичных аминов. Диалкиламиногруппы R2N являются более сильными активирующими заместителями, чем аминогруппа. Поэтому третичные ароматические амины обрабатывают электрофильными агентами в мягких условиях:
7.3 Сульфирование. Сульфирование анилина проводят концентрированной серной кислотой при 180–200 оС, в промышленности этот метод известен как запекание, продуктом реакции является анилин-4-сульфокислота (сульфаниловая кислота):
8.Реакции конденсации 8.1 Реакции конденсации первичных аминов. Первичные амины взаимодействуют с карбонильными соединениями с образованием иминов, производные алифатических аминов, как правило, малоустойчивы:
Ароматические амины образуют устойчивые имины (основания Шиффа):
Эти реакции протекают как АN по карбонильной группе с промежуточным образованием аминоспирта и последующим отщеплением молекулы воды. 8.2 Вторчные амины (енамины). Вторичные амины не образуют имины, т. к. имеют единственный протон у атома азота. При наличии Н-атома в β-положении к карбонильной группе исходного карбонильного соединения стадия элиминирования протекает с его участием и завершается образованием енамина:
8.3 Реакции конденсации третичных аминов:
9. Реакция изомеризации. При нагревании под давлением возможна изомерия метильных групп при атоме азота:
п-толуидин ксилидин мезидин
10. Гидрирование. При гидрировании анилина в присутствии катализатора образуется циклогексиламин:

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|