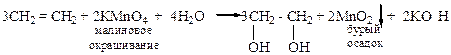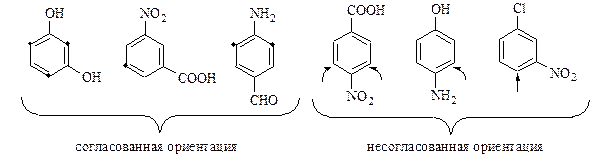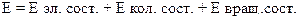|
|
Современная электронная интерпретация правила Марковникова.Направление реакции присоединения к несимметричным алкенам и алкинам реагентов типа НХ (HCl, HBr, HOH, NH3, HCN, CH3OH, HOCl, CH3-SH и др.) определяется: · распределением электронной плотности у реакционных центров под влиянием заместителей (статический фактор); · стабильностью интермедиата (кинетический фактор); · условиями проведения реакции. Примеры реакций присоединения, идущих: · А – по правилу Марковникова
· Б – против правила Марковникова
3. Стереоспецифичность реакции бромирования алкенов (циклоалкенов)– образование только транс-аддукта. В случае циклоалкенов транс-аддукты являются транс-изомерами. Химизм:
энантиомеры транс-1,2- дибромциклогексаны Механизм АЕ:
неполярная (полярный полярная молекула растворитель) молекула
Внешний эффект реакции: обесцвечивание желтого раствора брома (бромной воды).
Стереоспецифичность реакции гидроксилирования алкенов (реакция Вагнера) Химизм:
Механизм:
Внешний эффект реакции 1. Исчезновение малиновой окраски перманганата калия. 2. Образование бурого осадка оксида марганца (IV). Химические особенности сопряженных диенов · повышенная термодинамическая устойчивость, ER ~ 15 кДж/моль; · повышенная реакционная способность в реакциях присоединения и полимеризации (в сравнении с алкенами); · вступают в реакции AE с образованием не только 1,2-аддукта, но и 1,4-аддукта.
6. Влияние заместителей на реакционную способность и ориентацию в реакциях электрофильного замещения в бензольном кольце
Таблица 25 – Классификация заместителей
Примечание: (+) – увеличение реакционной способности; (–) – уменьшение реакционной способности. Таблица 26 – Типы реакций SE аренов.
– могут вступать в реакции с нуклеофильными реагентами.
Механизм ориентирующего влияния заместителей Влияние заместителей на реакционную способность и ориентацию в реакциях SE можно интерпретировать с позиций: · статических факторов (распределение электронной плотности в бензольном кольце под влиянием заместителя и стерические возможности атаки электрофила); · кинетических факторов (стабильность интермедиата – карбкатиона). Стабильность карбкатиона определяется степенью делокализации его положительного заряда. Делокализацию заряда можно изобразить: · методом мезомерии; · методом резонанса, т. е. с помощью набора предельных (резонансных структур).
Резонансные структуры карбкатиона (3)
Карбкатион (3) менее стабилен, чем (1), т.к. в его стабилизации не участвует заместитель. Таблица 27 – Согласованная и несогласованная ориентация электрофильного замещения у дизамещенных бензола
Примечание: М – мезомерный эффект; м – мета-положение.
Примеры
Правила ориентации · при наличии сильной и слабой активирующих групп ориентация определяется сильной группой; · при наличии активирующей и дезактивирующей групп ориентация определяется активирующей группой; · в случае двух заместителей в м-положении независимо от их ориентирующего влияния третья группа между ними не становится из-за стерических затруднений.
Таблица 28 – Реакции идентификации углеводородов
ОПТИЧЕСКАЯ СПЕКТРОСКОПИЯ Оптическая спектроскопия – основана на избирательном поглощении веществом электромагнитного излучения в диапазоне длин волн 10-6 см – 10 см.
Рисунок 22 – Область электромагнитного спектра, используемая в оптической спектроскопии.
Причина избирательного поглощения. Причина избирательного поглощения веществом определенных лучей заключается в квантованности внутренней энергии молекулы, которая складывается из энергий электронного, колебательного и вращательного состояний.
При действии на молекулу определенного кванта света электроны или молекулы переходят из основного состояния с низшей энергией Е0 в возбужденное состояние на дозволенный энергетический уровень Е1. Этот переход реализуется только в том случае, если квант поглощенного света hυ соответствует разности энергии возбужденного и основного состояния.
Спектр поглощения (спектральная кривая поглощения) – кривая зависимости интенсивности погашения (А) или пропускания (Т) от длины волны (λ) или волнового числа.
Для построения адсорбционных кривых на оси абсцисс откладывают длины волн λ или волновые числа ΰ, на оси ординат – фактор интенсивности (в электронной спектроскопии А-погашение, в ИК-спектроскопии Т% - процент пропускания).
УФ – спектр ИК – спектр
В оптической спектроскопии применяется закон Бера–Бугера–Ламберта, связывающий величину погашения излучения и количество поглощающего вещества.
где А – погашение, ε – молярный коэффициент погашения (экстинция), b – длина оптического пути в сантиметрах (толщина кюветы), с – концентрация в моль/л. Электронная спектроскопия. Поглощение электромагнитного излучения в видимой и УФ- областях связано с переходом электронов связывающих σ- и π-орбиталей, а также n-электронов несвязывающих гибридных и р-орбиталей на соответствующие разрыхляющие орбитали. ВЗМО – высшая занятая молекулярная орбиталь. НСМО– низшая свободная молекулярная орбиталь. Хромофор – структурный фрагмент молекулы, обусловливающий избирательное поглощение света с характеристическими величинами λ и ε. Ауксохром – заместитель в структуре хромофора, который обеспечивает батохромное смещение и гиперхромный эффект. Убрать рамки в эл перех
σ®σ* >π®π* ≥ n®σ* >n®π* >πВЗМО®π*НСМО> n ®π*НСМО Рисунок 24 –Типы электронных переходов. Батохромное смещение – смещение полосы поглощения в сторону длинных волн. Гипсохромное смещение – смещение в сторону коротких волн. Гиперхромный эффект заместителя – повышение интенсивности полосы поглощения. Гипохромный эффект – уменьшение интенсивности полосы поглощения. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|


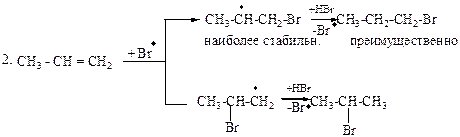


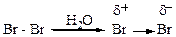
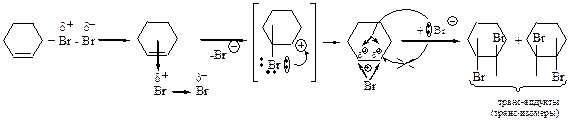 π-комплекс карбкатион катион бромония
π-комплекс карбкатион катион бромония