
|
|
Краткие сведения о сущности способа ионного обмена и ионообменной технологииСущность способа ионного обмена состоит в том, что твердое нерастворимое вещество – ионит реагирует с раствором, поглощая из него определенные ионы в обмен на другие ионы, входящие в состав ионита. Ионный обмен происходит в эквивалентных количествах и подчиняется закону действующих масс. Технология ионного обмена включает: 1) стадию поглощения ионитом из раствора извлекаемого иона, которую принято называть сорбцией, независимо от действительного механизма процесса; 2) стадию вымывания или элюации поглощенного иона с ионита в раствор. Кроме этих двух основных стадий имеются стадии подготовки, промывки и регенерации ионита. Целью ионообменного процесса является либо концентрирование раствора, либо очистки извлекаемого металла от примесей или разделение близких по свойствам элементов. В настоящее время в качестве ионитов применяют главным образом органические синтетические вещества – ионообменные смолы. Ионообменная смола состоит из каркаса (матрицы), представляющего собой высокополимерную пространственную сетку углеводородных цепей различного состава (например, сополимер полистирола и дивинилбензола), в который введены и с которыми химически связаны ионогенные группы (например, SO3H), состоящие из фиксированных ионов Ионогенная группа в целом электронейтральна, а фиксированные ионы несут заряд, в зависимости от знака которого иониты разделяются на катиониты и аниониты, способные к обмену катионов или анионов раствора. В качестве фиксированных ионов наиболее распространены следующие: у катионитов – у анионитов – В зависимости от степени диссоциации ионогенных групп на фиксированные ионы и противоионы, способные к обмену, катиониты разделяются на сильно-, средне- и слабокислотные, а аниониты – на сильно-, средне- и слабоосновные. Сильноосновные м сильнокислотные иониты содержат полностью диссоциированные группы и осуществляют обмен в широком интервале значений рН. Если ионит содержит не одну, а две, а иногда и три ионогенные группы, его называют полифункциональным в отличие от многофункционального, содержащего лишь одну ионогенную группу. В отечественной промышленности широкое применение имеет сильнокислотный катионит марки КУ-2, представляющий собой ионофункциональный сополимер полистирола и дивинилбензола, содержащий сульфогруппу SO3H, полностью диссоциированную на ионы Из анионитов широкое промышленное применение в отечественной практике имеют несколько, среди них сильноосновной монофункциональный анионит марки АВ-17, содержащий ионогенные группы – (CH3)3OH, и слабоосновной функциональный анионит марки АН-1, содержащий первичные и вторичные аминогруппы и триазиновые кольца. В процессе ионного обмена иониты проявляют селективность, т.е. предпочтительное поглощение одних ионов перед другими при совместном их присутствии в растворе, основанную на различном «сродстве» ионов к смоле. На основании экспериментальных работ установлены последовательности поглощения катионов и анионов различными ионитами. В производстве способ ионного обмена осуществляют в статистических или динамических условиях. Последнее более распространено и осуществляется путем пропускания раствора с определенной скоростью через колонну, заполненную ионитом. В этом случае сначала насыщаются верхние слои ионита, а затем постепенно нижние. При работе в динамических условиях различают полную обменную емкость ионита (ПОЕ) – количества вещества, поглощенного из раствора единицей веса ионита при полном насыщении смолы, и рабочую обменную емкость (РОЕ) – количество вещества, поглощенного смолой из раствора до момента «проскока», т.е. появления поглощаемого иона в фильтрате. Емкость ионита обычно определяют по выходным кривым сорбции (кривым поглощения), которые выражают зависимость концентрации извлекаемого иона в фильтрате от количества пропущенного раствора. Процесс элюации характеризуется выходными кривыми элюации (кривыми вымывания), выражающими зависимость концентрации вымываемого иона в фильтрате (элюате) от количества пропущенного раствора (элюента). Оптимальные условия поглощения и элюации ионов разрабатывают экспериментально. В молибденовой промышленности метод ионного обмена применяется для извлечения молибдена из различных маточных растворов и промывных вод производства молибдата аммония и молибдата кальция, растворов, получаемых при выщелачивании бедного сырья, а также для извлечения молибдена из рудных вод. Растворы содержат, как правило, от 0,5 до 5 г/м молибдена и значительное количество ионов
Содержание работы и порядок выполнения Лабораторная работа состоит из двух частей: 1. Изучение сорбции молибдена из раствора на смоле АН-1. 2. Изучение элюации поглощенного АН-1 молибдена раствором аммиака. В задачу первой части работы входит определение полной обменной емкости анионита АН-1 по молибдену в условиях, соответствующих производственным, при поглощении молибдена из маточных растворов производства парамолибдата аммония и изучение влияния скорости пропускания раствора через слой ионита на рабочую обменную емкость. Во второй части работы требуется установить возможную степень концентрирования раствора за цикл сороция-элюация и выявить зависимость между степенью концентрирования раствора и величиной извлечения молибдена из исходного раствора в элюат. Работа выполняется на установке, состоящей из стеклянной бюретки ÆВН=10 мм, =45см, заполненной смолой АН-1. Навеска смолы – 8 г, крупность зерен смолы – 1÷0,2 мм. Высота слоя, предварительно набухшей в дистиллированной воде смолы, составляет 12-13 см. т.е. отношение Н:Д=(12÷13):1. Смола полностью подготовлена для проведения сорбции молибдена, т.е. после набухания переведена в Исходный раствор молибдата аммония, содержащий 1,5 г/л молибдена, дистиллированная вода и элюент – 5%-ый раствор NH3 подаются самотеком из бутылей, установленных выше верхнего края бюретки. При этом растворы пропускаются через слой смолы сверху-вниз, а дистиллированная вода для промывки подается снизу-вверх для взрыхления смолы. Для регулирования скорости подачи растворов служат зажимы. Фильтрат из бюреток собирается в мерные цилиндры порциями по 50 мл, при сорбции молибдена на смолу, и по 10 мл при элюации.
1 часть. Изучение сорбции молибдена на смоле АН-1 Первая часть работы состоит в снятии выходных кривых поглощения молибдена при разных скоростях пропускания раствора. Исходный раствор молибдата аммония с концентрацией молибдена 1,5 г/л и рН=3,0 (подкислен HCl) пропускают через слой смолы со скоростью 4 мл/мин, 6 мл/мин, 8 мл/мин. Заданную скорость устанавливают с помощью секундомера и мерного цилиндра на 10 мл при пропускании дистиллированной воды, а затем начинают подачу в бюретки раствора и отсчет количества пропущенного раствора. В последовательно вытекающих порциях раствора по 50 мл определяют концентрацию молибдена калориметрическим методом на фотокалориметре ФЭК-1. Методика определения молибдена дана ниже в описании работы. Работу выполняют совместно два студента, один из которых следит за пропусканием раствора, а второй выполняет анализ фильтрата. Пропускание раствора с одной скоростью происходит непрерывно без остановок, и заканчивается при достижении концентрации молибдена в фильтрате 0,2 г/л. Результаты анализов представляют в форме таблицы 1 и на их основании строят кривые поглощения молибдена при разных скоростях пропускания раствора. Таблица 1 Форма записи результатов опытов сорбции молибдена на АН-1
По кривым поглощения рассчитывают рабочую емкость ионита в условиях эксперимента, принимая концентрацию «проскока», равной 0,015 г/л, что соответствует степени извлечения молибдена при сорбции 99%. Рабочую обменную емкость выражают в % от веса воздушно-сухой смолы. На основании полученных данных строят график зависимости величины рабочей обменной емкости смолы от скорости пропускания раствора путем графической экстраполяции величин рабочей емкости на нулевую скорость раствора и получают ориентировочную величину полной обменной емкости ионита АН-1 по молибдену в условиях эксперимента.
2 часть. Изучение элюации молибдена раствором Элюацию проводят 10%-ым раствором NH3 со смолы, полностью насыщенной молибденом. Количество молибдена на смоле рассчитывают, исходя из полученных в первой части работы данных о ПОЕ АН-1 для навески смолы 8 г. Раствор NH3 (элюент) пропускают со скоростью 2 мл/мин или 3 мл/мин и отбирают фильтрат (элюат) порциями по 10 мл. Скорость пропускания раствора устанавливают, как описано выше, по дистиллированной воде. Всего пропускают 100 мл раствора, т.е. отбирают 10 порций элюата и производят их анализ на молибден калориметрическим способом. Результаты опытов представляют в форме табл.2, а также изображают графически кривые элюации молибдена раствором NH3, зависимость извлечения молибдена со смолы в элюат от количества элюента и зависимость степени концентрирования раствора в цикле сорбция – элюация от извлечения молибдена в элюат. Таблица 2 Форма записи результатов опытов элюации молибдена со смолы АН-1 раствором
Допуск к выполнению работы производится по результатам программированного безмашинного контроля знаний теоретического материала по разделу курса «Основы ионообменных процессов». Отчет о работе должен включать краткое изложение содержания работы, протокольных данных опытов и результаты их обработки в виде графиков и расчетных величин с объяснением полученных зависимостей.
Литература 1. Погорелый А.Д. Теория металлургических процессов. – М., 1971, с. 477-501. 2. Зеликман А.Н., Беляевская Л.В., Вольдман Г.М. Теория гидрометал-лургических процессов. – М.: Металлургия, 1975. с. 226-284.
ЛАБОРАТОРНАЯ РАБОТА №7

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 и противоионов Н+, способных к обмену с ионами раствора.
и противоионов Н+, способных к обмену с ионами раствора. ,
, 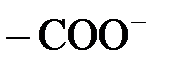 ,
,  ,
, 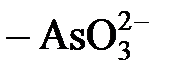
 ,
, 
 ,
,  N+,
N+,  S+
S+ ,
, 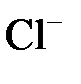 или
или  . Для извлечения молибдена наибольшее распространение в отечественной промышленности получил анионит АН-1 в
. Для извлечения молибдена наибольшее распространение в отечественной промышленности получил анионит АН-1 в