|
|
ИССЛЕДОВАНИЕ ЗАВИСИМОСТИ СКОРОСТИ ГЕТЕРОГЕННОГО ПРОЦЕССА ОТ КОНЦЕНТРАЦИИ РЕАГИРУЮЩИХ ВЕЩЕСТВ.ЛАБОРАТОРНЫЙ ПРАКТИКУМ ПО ТЕОРИИ ГИДРОМЕТАЛЛУРГИЧЕСКИХ ПРОЦЕССОВ
Владикавказ 1991 СОДЕРЖАНИЕ Тем лабораторных работ
1. Исследование зависимости скорости гетерогенного процесса от концентрации реагирующих веществ........................................................... 3 2. Определение влияния температуры на скорость гетерогенного процесса...................................................................................................................... 13 3. Исследование закономерностей внешней диффузии в стационарном режиме................................................................................. 19 4. Исследование кинетики гетерогенного процесса с внутренней дифузией.................................................................................. 25 5. Физическое моделирование процесса псевдоожижения............................ 34 6. Исследование закономерностей извлечения молибдена из бедных растворов с помощью анионита АН-1....................................................... 40 7. Закономерности экстракции молибдата трибутилфосфатом.................... 47 8. Исследование закономерностей осаждения из растворов гидроокисей и сульфидов металлов................................................................................. 53
ЛАБОРАТОРНАЯ РАБОТА № 1
ИССЛЕДОВАНИЕ ЗАВИСИМОСТИ СКОРОСТИ ГЕТЕРОГЕННОГО ПРОЦЕССА ОТ КОНЦЕНТРАЦИИ РЕАГИРУЮЩИХ ВЕЩЕСТВ.
Цель работы: путём исследования конкретного гидрометаллургического процесса 1) установить функциональную зависимость скорости процесса от концентрации исходного реагирующего вещества в растворе, 2) определить константу скорости и порядок реакции для данного реагента. Основные теоретические положения работы. Для обеспечения заданной скорости гидрометаллургического процесса необходимо поддерживать технологические параметры на необходимом уровне. Концентрация реагента (щёлочи, кислоты, соли) в водном растворе является решающим фактором обеспечения скорости процесса. Оптимальные концентрации реагирующих веществ определяются экспериментально, путём исследования зависимости скорости процесса от концентрации каждого из реагирующих веществ. В простых случаях по зависимости c = f(τ) (c – концентрация исследуемого реагирующего вещества, Задача формальной кинетики – составить уравнение, позволяющее в любой момент рассчитать скорость реакции, как функцию концентрации растворённых реагирующих веществ. Гетерогенный процесс происходит на поверхности реакции (поверхность твёрдого компонента, граница раздела фаз), поэтому за скорость процесса принимают количество (массу) вещества dmi , реагирующего на единице S в единицу времени dτ. Эта величина называется «плотность потока вещества» ϳ
О скорости гетерогенного процесса можно судить: 1) по изменению массы твёрдого компонента в процессе опыта; 2) по изменению массы какого-либо реагирующего вещества в водном растворе. Если в процессе эксперимента объёма жидкой фазы не изменится (V ≠ f(τ)), то dmi=в(v∙ci) и
Участвующие в реакции вещества (и твёрдые и растворённые) реагируют в эквивалентных количествах, поэтому скорость процесса в целом можно выразить через производную массы dmi или концентрации dci по времени dτ любого реагирующего вещества или продукта реакции. Например, для гетерогенного процесса αAтв+bBp-p =gGp-p +hHp-p (3) соотношение скорости расходования реагирующих веществ и образования продуктов реакции, а также процесса в целом определяется уравнением:
В зависимости от конкретных условий гидрометаллургического гетерогенного процесса о скорости его судят: 1) по убыли массы твёрдого компонента; 2) по изменению концентрации одного из растворённых участников реакции, химический анализ которого обеспечивает наименьшую погрешность, а изменение концентрации наиболее существенно. Обычно это один из продуктов реакции, т.к. исходные вещества берутся в избытке и их концентрация во времени почти не изменяется. Следовательно, правомерно написать для любого растворённого реагирующего вещества
где ki – константа скорости реакции по i-му компоненту; ni – порядок реакции по реагенту i. Для простых реакций, протекающих в одну стадию, порядок процесса совпадает с её молекулярностью и принимает значение 1 или 2. Для сложных гетерогенных процессов в системе твёрдое–раствор, протекающих через несколько последовательных стадий, порядок по какому-либо компоненту может иметь любое значение, как целое, так и дробное. При исследовании зависимости скорости процесса от концентрации определяют порядок реакции по каждому из компонентов, применяя уравнение (5). После установления порядка реакции по всем веществам, которые находятся в растворе и влияют на скорость гетерогенного процесса, составляют общее уравнение формальной кинетики.
Таким образом, задача формальной кинетики сводится к составлению уравнения (6) и определению численного значения константы скорости процесса, а так же порядка процесса по каждому реагирующему веществу. Константа скорости процесса представляет собой скорость процесса при концентрациях всех реагирующих веществ, равных 1. В исследованиях по изучению влияния на скорость процесса любого фактора, кроме концентрации (температура, вязкость, скорость перемешивания) за эффективную скорость принимают константу скорости. На величину кажущегося порядка реакции влияют много факторов и в т.ч. условия эксперимента. Например, если в растворе исходные вещества взяты в количестве, значительно превышающем количество растворённого твёрдого компонента, изменение концентрации исходного реагирующего вещества не произойдёт. Эффективный (кажущийся) порядок реакции по реагирующим веществам окажется равным 0. В таком случае в условиях эксперимента (или производственных условиях) скорость процесса в целом не будет зависеть от концентрации исходных реагирующих веществ. О порядке процесса по какому-либо компоненту можно судить по виду зависимости концентрации его в растворе от продолжительности процесса: ci = f(τ) (7) Если порядок по реагенту ni = 1 то после интегрирования уравнения (5) получим:
где со – концентрация i-го компонента в исходном растворе (τ = 0); сτ – его концентрация по истечении времени с начала процесса. В координатах Для случая ni ≠1 интегрирование зависимости (5) приводит к следующему уравнению:
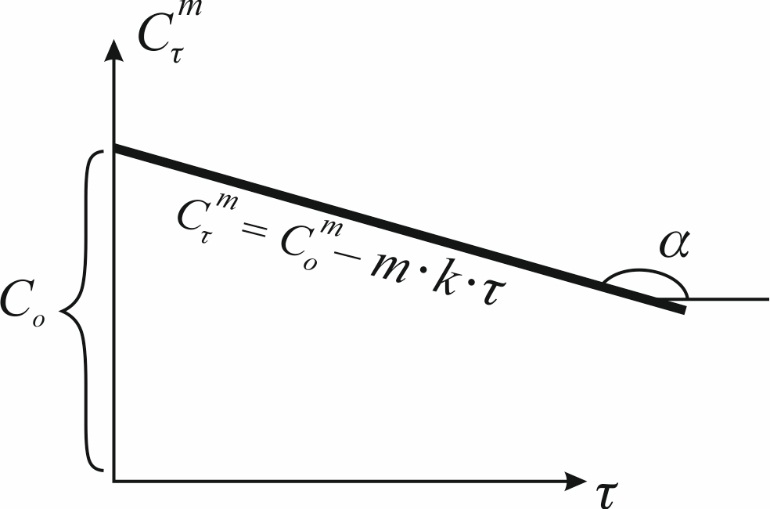
при n<1 уравнение (9) принимает вид:
В координатах сm– τ последнее уравнение имеет вид прямой линии (рис.2). По тангенсу угла наклона прямой линии к оси абсцисс рассчитывают константу скорости процесса: при n>1 уравнение (9) преобразуется к виду:
В координатах

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 – продолжительность процесса) можно судить о механизме процесса. Однако гораздо чаще зависимость c = f(τ) имеет сложный вид и по ней не удаётся расшифровать механизм процесса.
– продолжительность процесса) можно судить о механизме процесса. Однако гораздо чаще зависимость c = f(τ) имеет сложный вид и по ней не удаётся расшифровать механизм процесса.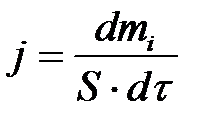 (1)
(1) (2)
(2)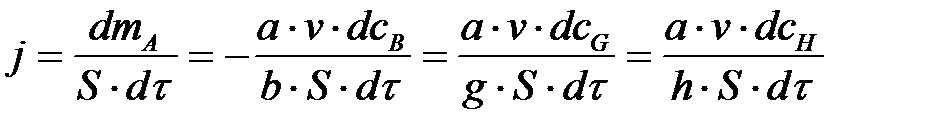 (4)
(4) (5)
(5) (6)
(6) (8)
(8) зависимость (8) принимает вид прямой линии, исходящей из начала координат, а тангенс угла наклона представляет собой константу скорости процесса (рис.1).
зависимость (8) принимает вид прямой линии, исходящей из начала координат, а тангенс угла наклона представляет собой константу скорости процесса (рис.1). (9)
(9) (9а)
(9а) ; (
; (  ) (9б)
) (9б) уравнение (9б) имеет вид прямой линии (рис.3), по тангенсу угла наклона которой можно рассчитать константу скорости процесса:
уравнение (9б) имеет вид прямой линии (рис.3), по тангенсу угла наклона которой можно рассчитать константу скорости процесса:  .
.