
|
|
Основные теоретические положения работыДля каждого гидрометаллургического процесса должна быть установлена оптимальная температура ее осуществления. Оптимальную температуру процесса определяют исходя из зависимости скорости процесса от температуры с учетом физико-химических свойств применяемых реагентов, технологии, аппаратурного оформления и экономической эффективности процесса. Исследование влияния температуры на скорость процесса – необходимое условие научного обоснования технологии любого процесса. В ходе исследований устанавливают функциональную зависимость скорости процесса от температуры системы. Чтобы исключить при этом влияние концентрации реагирующих веществ, за скорость процесса принимают константу скорости в уравнении формальной кинетики. Наиболее теоретически обоснованную зависимость скорости процесса от температуры предложил Аррениус:
где Kэксп – экспериментально определенная константа скорости процесса; Е – энергия активации. Только незначительная часть столкновений молекул реагирующих веществ приводит к протеканию реакции:
нормальные молекулы Первая стадия процесса протекает быстро, вторая – медленно и она определяет скорость всего процесса. Исходя из теории активных столкновений С. Аррениуса, Е – это тепловой эффект перехода нормальных молекул в активные, т.е. «энергия активации». Современное истолкование природы теплоты Е дает теория активных столкновений, согласно которой «энергия активации» – это минимальное значение суммарной кинетической энергии сталкивающихся молекул, которое обеспечивает вступление их в реакцию между собой. Эта энергия необходима для разрыва или ослабления связей в молекулах реагирующих веществ, в результате чего происходит образование активированного комплекса (промежуточного вещества). Величина Е зависит от природы и строения молекул исходных реагирующих веществ и продуктов реакции, а также от механизма процесса (кинетический или диффузионный). Для каждого процесса величина Е характеризует зависимость скорости процесса от температуры. Интегрирование уравнение С. Аррениуса приводит к следующему виду зависимости скорости процесса от температуры:
где В – коэффициент, зависящий от массы, размеров и строения молекул исходных реагирующих веществ, растворителя, температуры. Так как В значительно меньше зависит от температуры
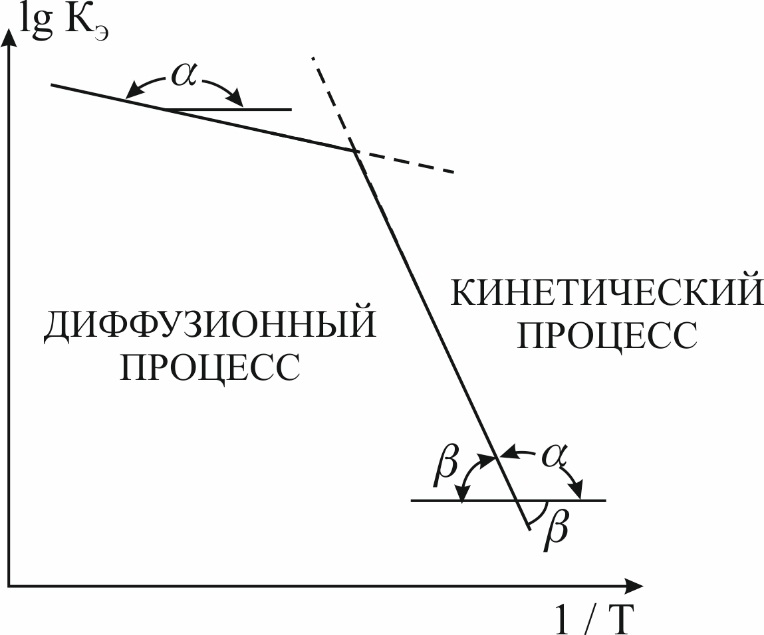
По тангенсу угла наклона прямой линии к оси абсцисс вычисляют энергию активации исследуемого процесса:
Рис. 1
Если R (ккал/моль 0), то Если R = 8,314 Дж/моль 0, то Так как угол a всегда тупой, то значение
В случае сложных реакций параметры В и Е в уравнении (2) теряют свой физический смысл и представляют эмпирические величины. В этом случае параметр Е называют кажущейся энергией активации. Если лимитирующей стадией является химическое превращение (кинетический процесс), то кажущаяся энергия активации имеет более высокие значения, чем для процессов, происходящих в диффузионной области. Если гетерогенный процесс происходит в промежуточной области, то зависимость Иногда для оценки влияния температуры на скорость процесса применяют температурный коэффициент под которым понимают относительное увеличение скорости процесса при повышении температуры системы на 10 К (10 °С). Чтобы исключить влияние изменения концентрации реагентов, температурный коэффициент вычисляют как отношение констант скорости, скорости процесса при различных температурах, отличающихся на 10 К (10 °С).
Если в условиях исследования исходные реагенты взяты в значительном избытке и в ходе эксперимента их концентрации практически не изменяются, тогда температурный коэффициент можно вычислять непосредственно по скорости процесса
Обычно для диффузионной области g = 1,5 , а для кинетической –g > 2.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 (1)
(1) активные молекулы
активные молекулы  (2)
(2) , чем
, чем  , то обычно принимают, что
, то обычно принимают, что 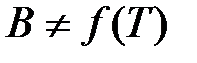 . Если обе части уравнения (2) прологарифмировать, то получится уравнение прямой линии в координатах (рис.1)
. Если обе части уравнения (2) прологарифмировать, то получится уравнение прямой линии в координатах (рис.1) (3)
(3) (4)
(4)
 , ккал/моль.
, ккал/моль. Дж/моль.
Дж/моль. всегда отрицательно, а Е всегда положительно. Имея в виду соотношение
всегда отрицательно, а Е всегда положительно. Имея в виду соотношение  , Е вычисляют по уравнению
, Е вычисляют по уравнению (5)
(5) представляет ломаную линию, на которой крутой участок в области низких температур соответствует кинетической области процесса, а пологий участок в области более высоких температур соответствует диффузионной области процесса. Переход от кинетической области процесса к диффузионной происходит при Е = 6-7 ккал/моль (25-30 кДж/моль). Поэтому по величине экспериментального значения Е судят об области протекания процесса: при Е > 6-7 ккал/моль (25÷30 кДж/моль) следует ожидать, что процесс кинетический, при меньших значениях Е – наиболее вероятно протекание процесса в диффузионной области. Но при этом необходимо учитывать, что значение энергии активации далеко не единственный и однозначный критерий для определения области протекания процесса.
представляет ломаную линию, на которой крутой участок в области низких температур соответствует кинетической области процесса, а пологий участок в области более высоких температур соответствует диффузионной области процесса. Переход от кинетической области процесса к диффузионной происходит при Е = 6-7 ккал/моль (25-30 кДж/моль). Поэтому по величине экспериментального значения Е судят об области протекания процесса: при Е > 6-7 ккал/моль (25÷30 кДж/моль) следует ожидать, что процесс кинетический, при меньших значениях Е – наиболее вероятно протекание процесса в диффузионной области. Но при этом необходимо учитывать, что значение энергии активации далеко не единственный и однозначный критерий для определения области протекания процесса.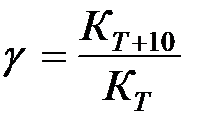 (6)
(6) (7)
(7)