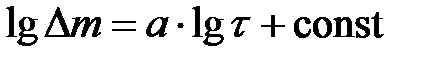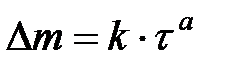|
|
Методика исследования и обработка результатов экспериментаВ качестве растворяемого минерала взять оксиды металлов CaO, BaO, MgO, PbO в качестве растворителя – H2SO4 или H2C2O4 (щавелевую кислоту). Процесс растворения указанных оксидов сопровождается образованием продукта, нерастворимого в водной среде, т.к. соли щавелевой кислоты (оксалаты) и сульфат свинца трудно растворимы в воде: MeOтВ + H2C2O4 = MeC2O4 тВ + H2O (Me : Ca, Ba, Mg) PbOтВ + H2SO4 = PbSO4 тВ + H2O В диффузионной области процесса растворенным реагентом, лимитирующем скорость процесса в целом, может быть только кислота. Образующиеся продукты реакции могут влиять на скорость процесса в целом по механизму образования на реакционной поверхности осадка, толщина которого изменяется во времени. Влияние другого продукта реакции – вода, очевидно, не существенно.
Описание лабораторной установки Лабораторная работа выполняется на установке, состоящей из механической (или магнитной) мешалки, стеклянного стакана и бюретки для титрования проб раствора.
Порядок проведения опытов 1. В мерный цилиндр набирают 200 мл раствора кислоты заданного состава и концентрации (табл.1) и переливают в стеклянный стакан емкостью 300 мл. Таблица 1 Варианты работы и условия опытов t = 25ºС
2. Отбирают пипеткой пробу раствора кислоты (5 мл) и определяют ее исходную концентрацию. 3. Взвешивают навеску твердой фазы (табл.1). 4. Вводят в приготовленный раствор мешалку и включают перемешивание. 5. Всыпают в стакан навеску твердой фазы и замечают время. 6. По истечении заданного времени (табл.2) останавливают мешалку, дают отстояться раствору (0,5 мин), пипеткой отбирают из осветленной зоны пробу раствора (5 мл). 7. Снова включают мешалку и ведут опыт в соответствии с табл.2. Таблица 2 Время взятия пробы раствора
8. Титруют пробы раствора содой Na2CO3 и записывают объем раствора соды, пошедшего на титрование в табл.3. Таблица 3 V = мл t = ºС Т = г/л
Методика анализа концентрации кислоты Пробу анализируемого раствора (5 мл) помещают в коническую колбу на 250 мл, разбавляют дистиллированной водой до 100 мл, добавляют несколько капель индикатора (метилоранж) и титруют 0,5 М раствором Na2CO3. Конец титрования определяют по переходу окраски раствора из слабо-розовой в желтую. Объем раствора соды ni , пошедшей на титрование пробы, записывают в табл.3.
Обработка результатов опыта 1. Рассчитывают концентрацию кислоты по формуле:
Т – титр 0,5 М раствора Na2CO3 по кислоте (для H2SO4 для H2С2O4 v – объем пробы, мл; ni – количество раствора соды, пошедшее на титрование пробы кислоты, мл. 2. Рассчитывают количество (массу) прореагировавшей кислоты по уравнению
где V – объем раствора, л. 3. Рассчитывают критерий Пиллинга-Бедвордса:
где в условиях опыта v = 1, а М и r см. в табл.4 Таблица 4 Молекулярные массы и плотности
По величине КП=Б делается предположение о возможном механизме гетерогенного процесса.
Литература 1. Зеликман А.Н., Вольдман Г.М., Беляевская Л.В. Теория гидрометаллургических процессов. – М.: Металлургия, 1975. с. 117-119, 185-204. 2. Франк-Каменецкий Д.А. Диффузия и теплопередача в химической кинетике. – М.: Наука,1967. с. 105-107, 131-132. 3. Шиврин Г.Н., Петрова В.А. Лабораторный практикум по теории гидрометаллургических процессов. – Красноярск, 1979. с. 39-50.
ЛАБОРАТОРНАЯ РАБОТА №5

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
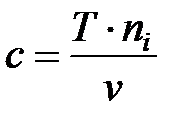
 г/мл;
г/мл; г/мл;
г/мл; , г
, г ,
, 4. Строят график зависимости
4. Строят график зависимости  . Определяют графически
. Определяют графически  . По величине а делают вывод о механизме процесса и составляют уравнение зависимости расхода кислоты от продолжительности процесса:
. По величине а делают вывод о механизме процесса и составляют уравнение зависимости расхода кислоты от продолжительности процесса: