
|
|
Высокомолекулярные соединения (ВМС)Содержание 6.1. Физические и химические свойства биополимеров 6.2. Факторы устойчивости ВМС
ВМС - это макромолекулы, которые получаются в результате реакции полимеризации или поликонденсации. К биологическим полимерам относятся белки, нуклеиновые кислоты, углеводы, липиды и продукты их взаимодействия. 6.1. Физические и химические свойства биополимеров во многом зависят от их структуры. Структура биополимеров: 1) глобулярная – правозакрученная спираль (α-спираль), которая изогнута таким образом, что в пространстве образуется некая сфера – глобула. Белки хорошо растворимы в воде и солевых растворах, они гидрофильны;
в воде, т.е. гидрофобны.
1) более высокой вязкостью; 2) набуханием; 3) способностью к желатинированию (гелеобразованию). Осмотическое давление в растворах ВМС нелинейно зависит от концентрации (см. график Росм = f (СВМС)). Определяется по уравнению Росм = СRT / M + bc2 ( уравнение Галлера) М - молярная масса, С – весовая концентрация ВМС (г/л), b - величина, зависящая от природы растворителя. С помощью этого уравнения на практике определяют молярную массу (М) полимера. Осмотическое давление в биологических жидкостях обусловлено наличием как низкомолекулярных соединений (электролитов и неэлектролитов), так и высокомолекулярных соединений - главным образом, белков. Осмотическое давление крови, которое обусловлено наличием высокомолекулярных соединений, называется онкотическим, его величина составляет ≈0,04 атм. Общее осмотическое давление крови 7,7 ± 8,1 атм. Вязкость растворов ВМС выше, чем у истинных и большей части коллоидных растворов. Определяют вязкость вискозиметрическим методом (см. методические указания к курсу). Различают относительную и удельную вязкости (η – «эта») растворов η раствора η t ηотн = ------------------ = ---------- = -------- η растворителя ηо to t - время истечения раствора из вискозиметра to - время истечения из вискозиметра того же объема растворителя. Вязкость растворов зависит от ряда факторов: 1. форма молекул: для растворов с асимметрической формой молекул вязкость выше; 2. температура: чем выше температура, тем ниже вязкость; 3. концентрация: чем больше концентрация ВМС, тем вязкость больше; 4. кислотность растворов (рН). Увеличение вязкости с увеличением концентрации принято характеризовать величиной удельной вязкости, которая показывает относительное повышение вязкости раствора: η раствора - η растворителя η - ηо
η растворителя ηо Удельная вязкость ВМС не прямо пропорциональна концентрации полимера (см. график η уд = f (СВМС)). Это связано с тем, что удельная вязкость зависит и от его молярной массы, в соответствии с уравнением Штаудингера: ηуд = k C M , С – весовая концентрация, (г/л) k –постоянная, зависящая от природы полимера.
Желатинирование- процесс превращения раствора ВМС в студень или гель. Макромолекулы связываются между собой, переплетаются, образуя рыхлую сетку, промежутки которой заполняет растворитель. В результате этого система теряет текучесть и превращается в гель. На процесс желатинирования оказывают влияние те же самые факторы, что и на вязкость растворов.
Набухание- процесс увеличения массы и объёма полимера за счёт избирательного поглощения растворителя. Процесс набухания характеризуется степенью набухания i.
m –mo i = , где m – масса ВМС после набухания; m0 - масса сухого ВМС. mo Факторы устойчивости ВМС 1) Гидратная оболочка макромолекулы. Когда макромолекула белка теряет гидратную оболочку (например, при попадании в спирт), устойчивость макромолекулы резко снижается и она коагулирует. 2) Электрический заряд макромолекулы, который появляется в результате её ионизации: диссоциации карбоксильных групп и ассоциации аминогрупп.
Значение рН, при котором макромолекула находится в изоэлектрическом состоянии, называется изоэлектрической точкой. В изоэлектрическом состоянии макромолекула теряет устойчивость и коагулирует, т.е.в изоэлектрической точке самая высокая скорость коагуляции. Кроме того, лишенная заряда, макромолекула ВМС (изоэлектрическое состояние) в электрическом поле будет неподвижной, поэтому в ИЭТ электрофорез ВМС не идет. Чтобы в электрическом поле макромолекула перемещалась к какому-либо из электродов надо изменить рН раствора.
Упражнения для самостоятельной работы: 1. К какому из электродов при электрофорезе будет двигаться макромолекула белка ИЭТ =4,7 при рН =2 и при рН= 7. 2. Определить порог высаливания и коагулирующую силу электролита, если на высаливание 10 мл белка расходуется 15 мл 30% раствора Mg(NO3)2 плотностью 1,2 г/мл.
Глава 7 Поверхностные явления Содержание 7.1. Явления, происходящие на границе раздела двух фаз 7.2. Поверхностно активные и поверхностно инактивные вещества. 7.3. Явление адсорбции на подвижных и неподвижных границах раздела фаз. 7.4. Адсорбция веществ из растворов 7.5. Избирательность адсорбции

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
 2) фибриллярная - β-структура. Биополимеры, обладающие такой структурой легко представить в виде складчатого листа, они имеют волокнистое строение и не растворимы
2) фибриллярная - β-структура. Биополимеры, обладающие такой структурой легко представить в виде складчатого листа, они имеют волокнистое строение и не растворимы Свойства растворов ВМС аналогичны свойствам всех коллоидных растворов, но обладают некоторыми особенностями:
Свойства растворов ВМС аналогичны свойствам всех коллоидных растворов, но обладают некоторыми особенностями: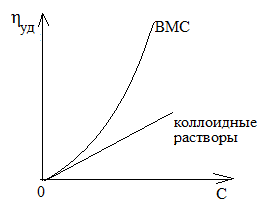 η уд = -------------------------------- = ---------
η уд = -------------------------------- = ---------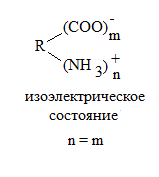 При определённом значении рН степень ионизации обеих групп становится одинаковой и тогда наступает изоэлектрическое состояние макромолекулы (общий молекулы заряд равен 0).
При определённом значении рН степень ионизации обеих групп становится одинаковой и тогда наступает изоэлектрическое состояние макромолекулы (общий молекулы заряд равен 0). Например, определим, к какому из электродов при электрофорезе будет двигаться макромолекула белка ИЭТ =5,2 при рН =3.
Например, определим, к какому из электродов при электрофорезе будет двигаться макромолекула белка ИЭТ =5,2 при рН =3.