|
|
Получение, свойства, строение коллоидных растворов.Содержание 5.1. Классификация дисперсных систем 5.2. Строение коллоидных частиц 5.3. Методы получения коллоидных растворов 5.4. Свойства коллоидных растворов 5.5. Коагуляция коллоидных частиц 5.6. Строение мицеллы слюны Классификация дисперсных систем. Системы, в которых одно вещество в раздробленном состоянии равномерно распределено в другом называются дисперсными. Совокупность частиц растворённого вещества называется дисперсной фазой, а среда называется дисперсионной. Дисперсные системы делят по величине частиц, т.е. по дисперсности. Большая группа растворов, величина частиц в которых 10-5 ÷ 10-7 см, называется коллоидными. В зависимости от природы растворителя все коллоидные растворы (золи) делят: гидрозоли (растворитель - вода), алкозоли (растворитель - спирт) и этерозоли (растворитель - эфир). По характеру взаимодействия дисперсной фазы и дисперсионной среды все золи делят: 1) лиофильные золи (гидрофильные) - в них происходит интенсивное взаимодействие между дисперсионной средой и дисперсной фазой; вокруг частиц дисперсной фазы образуется гидратная или сольватная оболочка; 2) лиофобные (гидрофобные) - в этих золях взаимодействие между дисперсной фазой и дисперсионной средой отсутствует или очень мало.
Строение коллоидных частиц В настоящее время строение коллоидных растворов описывается мицеллярной теорией, согласно которой, любой гидрофобный золь состоит из мицеллы и интермицеллярной жидкости - среды, содержащей растворимые электролиты. Мицелла - это электронейтральная структурная единица дисперсной фазы коллоидного раствора. Основная масса мицеллы сосредоточена в ядре. Ядро состоит из большого числа молекул или атомов вещества, нерастворимого в дисперсионной среде. Количество молекул в ядре обозначается m. К поверхности ядра притягиваются ионы, сообщая поверхности тот или иной заряд. Это потенциалобразующие ионы, их количество обозначается n. Потенциалобразующими ионами могут быть только те ионы, которые входят в состав ядра (в соответствии с правилом Панета – Фаянса: на твердом адсорбенте из дисперсионной среды адсорбируются ионы, входящие в состав адсорбента или имеющие с ним общую группировку атомов). К поверхности, имеющей заряд, притягиваются ионы противоположного знака - это противоионы. Их общее число n, но прочно удерживается только часть в количестве (n-х). Потенциалопределяющие ионы вместе с частью противоионов образуют адсорбционный слой. Ядро вместе с этим слоем образует гранулу. Гранула имеет заряд. Оставшаяся часть противоионов окружает гранулу и образует диффузионный слой. Гранула вместе с диффузионным слоем образует электронейтральную мицеллу. Методы получения коллоидных растворов Коллоидные растворы по размерам частиц занимают промежуточное положение между грубодисперсными и истинными. Поэтому выделяют две группы методов их получения: 1) дисперсионные (дробление грубодисперсных частиц до частиц коллоидной степени дисперсности); 2) конденсационные (укрупнение частиц истинных растворов в агрегаты коллоидных систем). Эти группы методов, в свою очередь, делятся на физические и химические. Самым распространённым из дисперсных химических методов получения золей является метод пептизации (процесс перевода осадка (гидроксида металла) в коллоидный раствор под действием диспергирующих средств). В качестве пептизатора используют хорошо растворимую соль соответствующего металла. Например, мицелла золя гидроксида железа (III) Fe(OH)3 получается в присутствии пептизатора FeCl3 –сильного электролита:
nFeCl3 ↔ n Fe3+ + 3nCl - { m [Fe(OH)3 ] nFe3+ 3(n - х) Сl - }+3x 3хСl - ядро адсорбционный слой диффузионный слой гранула К конденсационным химическим методам относят: 1) метод обменной реакции, в ходе которой получается нерастворимое вещество, причём одно исходное вещество должно быть в избытке: AgNО3 + KI → AgI ↓ + KNО3 избыток nAgNО3 ↔ nAg+ + n NO3‾ { m[AgI] nAg+ (n - x)NO3‾ }+x xNO3‾ ядро адсорбционный слой дифф. слой гранула 2) метод гидролиза, в результате которого получается нерастворимое соединение. FeCl3 + ЗН2О → Fe(OH)3↓ +3HCl, Fe(OH)3 + HCl → FeОCl + 2H2O Продукт этой реакции – хлорокись железа(III) может диссоциировать и стабилизировать мицеллообразование. FeOCl ↔ FeO+ +Сl‾ { m[Fe(OH)3 ] nFeO+ (n - х)Сl‾ }x+ хСl‾ 3) метод окислительно-восстановительных реакций
5.4.Свойства коллоидных растворов 1. Молекулярно-кинетические свойства, общие для истинных и коллоидных растворов: осмос, осмотическое давление, диффузия, броуновское движение. Но в коллоидных растворах эти процессы идут медленнее. 2. Оптические свойства – это специфические свойства, присущие только коллоидным растворам. a) опалесценция - это явление рассеяния проходящего через коллоидный раствор света с изменением окраски золя. b) эффект Фарадея-Тиндаля - явление изменения формы пучка проходящего через раствор света на конусовидную. 3. Электрические свойства a) электрофорез - явление перемещения частиц дисперсной фазы в электрическом поле; b) электроосмос - это явление перемещения частиц дисперсионной среды (растворителя) относительно неподвижной дисперсной фазы. Например, течение жидкости через капиллярные системы под влиянием разности потенциалов. На этих свойствах основаны методы введения лекарственных препаратов через кожу. 4. Электрокинетические свойства характеризуют возникающие в мицелле потенциалы. a) электротермодинамический (Е) потенциал - возникает на границе ядра и слоя потенциалопределяющих ионов. Величина этого потенциала постоянна и зависит от числа потенциалопределяющих ионов, у многих коллоидных растворов она достигает 1В. b) электрокинетический ζ, (дзетта) потенциал - возникает на границе адсорбционного и диффузионного слоев. Величина ζ - потенциала пропорциональна числу ионов диффузионного слоя и ионной силе раствора. Концентрация противоионов в диффузионном слое убывает от центра к периферии, ζ-потенциалв этом направлениитак же падает до нуля. Если все противоионы перейдут в адсорбционный слой, то ζ-потенциал станет равен 0. Состояние системы, когда общий заряд её равен нулю, называется изоэлектрическим состоянием. Коллоидные растворы являются термодинамически неустойчивыми.
Коагуляция коллоидных частиц Процесс ассоциации (укрупнения) коллоидных частиц в золях под действием внешних факторов называется коагуляцией. Основными факторами устойчивости коллоидных растворов являются: а) наличие у гранул одноименных зарядов, что приводит к их взаимному отталкиванию: снижение заряда может приводить к потере устойчивости. б) величина ζ –потенциала, которая зависит от числа ионов в диффузионном слое и от ионной силы раствора. Снижение величины ζ –потенциала ниже критической, например, вследствие дегидратации ионов диффузного слоя под действием других электролитов или белков и вытеснение их в адсорбционный слой, приводит к коагуляции. Правила коагуляции 1) Наличие любого электролита вызывает коагуляцию. Минимальная концентрация электролита, вызывающая явную коагуляцию золя, называется порогом коагуляции (Пк) и определяется числом миллимолей электролита, пошедшего на коагуляцию 1л раствора золя. ν ммоль электролита ПК = Vзоля , л 2) Правило Шульце-Гарди: коагулирующим действием обладает лишь тот ион электролита, заряд которого противоположен заряду гранулы, причём его коагулирующая сила (I) тем больше, чем больше валентность иона. Это связано со способностью многовалентных ионов сильнее гидратироваться, т.е. связывать большее число молекул воды и тем самым сильнее дегидратировать ионы диффузного слоя мицелл. 3) В ряду неорганических ионов одинаковой валентности их коагулирующая сила иона (I) убывает, согласно следующим лиотропным рядам: Cs+ > K+ > Na+ Cl ‾ > Br‾ > I‾ > CNS¯ убывание коагулирующей силы иона Коагулирующая сила иона (I) – это величина, обратная величине порога коагуляции.
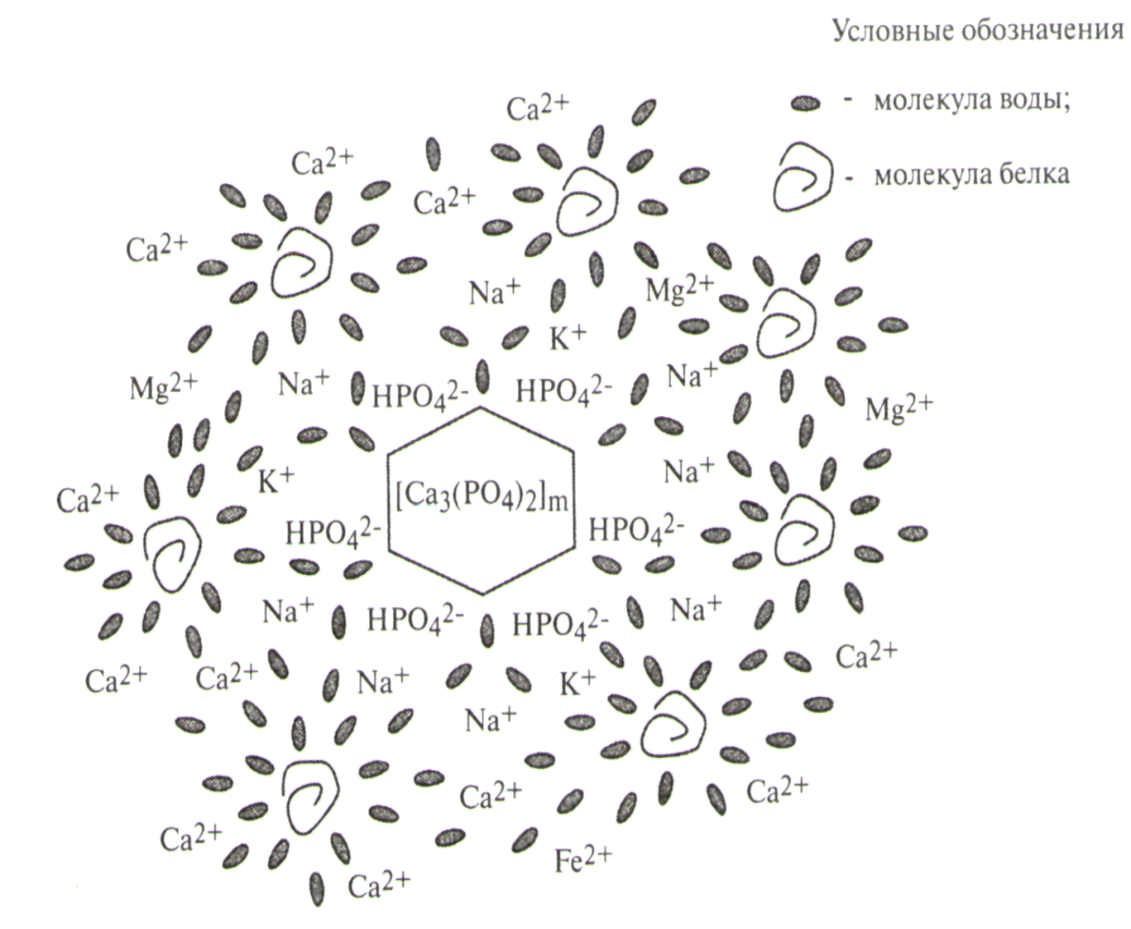
Строение мицеллы слюны. Поддержание нерастворимых солей кальция Ca3(PО4)2 и CaНPО4 в псевдорастворенном состоянии в составе слюны возможно благодаря мицеллообразованию. Считается, что ядро мицеллы слюны состоит из молекул нерастворимого фосфата кальция m[Ca3(P04)2], на поверхности которого в качестве потенциалопределяющих ионов распределяются находящиеся в избытке гидрофосфат - ионы (НР042-). В качестве противоионов адсорбционного слоя и в диффузном слое мицеллы находятся ионы K+ (Na+). Строение мицеллы можно представить в виде: {m[Ca3(P04)2]n(НР042-) 2 (n –x) К+}2х- 2x К+ Кроме ионов К+ и Na+ на периферии диффузного слоя и в интермицеллярной жидкости находятся ионы Са2+ и в меньшей степени некоторые другие двухвалентные ионы, отделенные водно-белковой оболочкой (см. рис.). При определенных условиях (например, при увеличении концентрации Са2+ или при уменьшении концентрации К+ и Na+) они могут вытеснять ионы К+ и Na+ из адсорбционного слоя, образуя труднорастворимый гидрофосфат кальция СаНРО4. Изменение состава или рН слюны за пределы её буферной емкости отражается на структуре мицелл. Снижение рН, уменьшает заряд гранулы, т.к. приводит к протонированию фосфатных групп потенциалобразующего слоя: НРО42- + Н+ → Н2РО4- Вследствие этого уменьшается устойчивость мицелл, и повышается вероятность коагуляции. При повышении рН слюны происходит депротонирование НРО42-, а образованные ионы РО43-, взаимодействуя с ионами кальция, формируют труднорастворимую соль Са3(РО4)2: НРО42- + ОН- ↔ Н2О + РО43- 2РО43- + ЗСа2+ → Са3 (Р О4)2
Рис. Строение мицеллы слюны.
Образованные нерастворимые соли кальция Ca3(P04)2 и CaНP04 являются новыми центрами кристаллизации. Буферная система слюны, поддерживающая рН, близким к нейтральному, а так же противоионы К+ (или Na+) адсорбционного слоя в физиологических концентрациях обеспечивают устойчивость мицелл. Аэрозоли Дисперсные системы, у которых дисперсионной средой является газ, называются аэрозолями. Диспергированным веществом в аэрозолях могут быть частицы твердого вещества (дым и др.), а также капельки жидкости (туман и др.). Устойчивость аэрозолей объясняется наличием электрического заряда, возникающим на поверхности раздела двух фаз, а кроме того, каждая частичка твердого или жидкого вещества адсорбирует на своей поверхности газ, в результате чего образуется оболочка, которая препятствует их объединению и, следовательно, быстрому оседанию. Аэрозоли широко применяются в военном деле (дымовые завесы и др.), в сельском хозяйстве и других отраслях народного хозяйства. Большое значение имеет распыление различных дезинфицирующих веществ: инсектицидов, гербицидов и т. п. при борьбе с вредителями (насекомыми, грибками, сорняками, микробами и др.). При разжигании костров в садах над определенным участком земли образуется стелющийся слой дыма, который задерживает теплоотдачу земли. На частицах аэрозоля, окутывающих деревья, происходит интенсивная конденсация водяных паров, и при этом выделяется скрытая теплота парообразования. Это предохраняет растения от замерзания. Некоторые аэрозоли могут быть вредны для здоровья человека. Дым производства загрязняет рабочие помещения и окрестности предприятий, уничтожает растительность и отрицательно влияет на здоровье населения. В промышленных городах при наличии в атмосфере больших количеств аэрозолей (дыма, пыли и т. п.) и влажности воздуха происходит образование туманов (например, в Лондоне). Грубодисперсные системы Грубодисперсными называются системы, в которых частицы дисперсной фазы имеют размеры не менее 10-5 см, к ним относятся эмульсии, пены, суспензии, порошки. Эмульсиями называют грубодисперсные системы из несмешивающихся жидкостей. Ряд свойств эмульсий сходен со свойствами собственно коллоидов: они также имеют выраженную поверхность раз; неустойчивы и нуждаются в стабилизаторах (эмульгаторах). Эмульсии могут образовывать только взаимно нерастворимые жидкости. Чаще всего эмульсии состоят из воды и жидкости, которую принято называть «масло». Молекулы масла менее полярны, чем молекулы воды. Возможны два типа эмульсий: масло в воде (м\в) и вода в масле (в/м). При энергичном взбалтывании смесей, состоящих из воды и масла, компонент, содержащийся в меньшем количестве, дробиться на мельчайшие капельки, распределяющиеся по всему объему. Образуется эмульсия, в которой капельки жидкости (дисперсная фаза) по свойствам очень сходны с частицами гидрофобного коллоида. Главным фактором их устойчивости также является заряд, возникающий либо за счет адсорбции некоторых ионов, либс счет диссоциации ионогенных (диссоциирующих на ионы) групп, которые могут содержаться в различных веществах, адсорбированных капельками эмульсии из раствора. Таким образом, капельки эмульсии имеют некоторый дзета-потенциал. Обычно концентрация дисперсной фазы в эмульсиях чистых жидкостей (без стабилизаторов) не превышает 2 об %. Устойчивость таких эмульсий невысока, легко происходит самопроизвольное слияние капелек дисперсной фазы (так называемая коалесценция) и последующее расслоение жидкостей. Чем меньше размер капелек, тем устойчивее эмульсии.
Упражнения для самостоятельной работы: 1. Написать мицеллу золя, полученного по реакции равных объёмов 0,4M сульфита натрия и 0,3М хлорида магния. 2. Написать мицеллу золя сульфида ртути (HgS) с отрицательным зарядом гранулы. 3. Определить для какого из электролитов: MgCl2, Na2CO3 , K3PO4 порог коагуляции золя с отрицательным зарядом гранулы будет меньше и почему? 4. На коагуляцию 10 мл золя пошло 5 г раствора Na2SO4. Определить порог коагуляции. Какой из электролитов KCI, Mg (NО3)2 или Na2SO4 имеет меньший порог коагуляции, если гранула заряжена положительно. 5. Электроосмос – a. явление перемещения частиц дисперсионной среды (растворителя) относительно неподвижной дисперсной фазы b. явление перемещения частиц дисперсной фазы в электрическом поле c. явление рассеяния проходящего через коллоидный раствор света 6. электрокинетический ζ, (дзетта) потенциал – a. возникает на границе ядра и слоя потенциалопределяющих ионов b. возникает на границе адсорбционного и диффузионного слоев c. зависит от числа ионов в диффузионном слое и от ионной силы раствора 7. Большая коагулирующая сила многовалентных ионов по сравнению с одновалентными обусловлена: a. способностью связывать большее число молекул воды и тем самым сильнее дегидратировать ионы диффузного слоя мицелл b. способностью вытеснять ионы из адсорбционного слоя гранул c. способностью сильнее взаимодействовать с ядром мицеллы Глава 6 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|