|
|
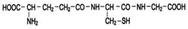
Метаболизм фенилаланина и тирозинаФенилаланин - незаменимая аминокислота, так как в клетках животных не синтезируется её бензольное кольцо. Тирозин - условно заменимая аминокислота, поскольку образуется из фенилаланина. Содержание этих аминокислот в пищевых белках (в том числе и растительных) достаточно велико. Фенилаланин и тирозин используются для синтеза многих биологически
Схема ГГлутатион
Схема A
Схема Б
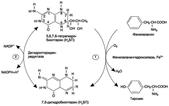
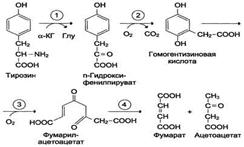
активных соединений. В разных тканях метаболизм этих аминокислот происходит поразному (рис. 9-28). 1. Метаболизм феиилаланина Основное количество фенилаланина расходуется по 2 путям: включается в белки; превращается в тирозин. Превращение фенилаланина в тирозин прежде всего необходимо для удаления избытка фенилаланина, так как высокие концентрации его токсичны для клеток. Образование тирозина не имеет большого значения, так как недостатка этой аминокислоты в клетках практически не бывает. Основной путь метаболизма фенилаланина начинается с его гидроксилирования (рис. 9-29), в результате чего образуется тирозин. Эта реакция катализируется специфической монооксиге-назой - фенилаланингидр(жсилазой, кофермен-том которой служит тетрагидробиоптерин (Н4БП). Активность фермента зависит также от наличия Fe2+. Реакция необратима. Н4БП в результате реакции окисляется в дигидробиоптерин (Н2БП). Регенерация последнего происходит при участии дигидроптеридинредуктазы с использованием NADPH + H+. 2. Особенности обмена тирозина Обмен тирозина значительно сложнее, чем обмен фенилаланина. Кроме использования в синтезе белков, тирозин в разных тканях выступает предшественником таких соединений, как катехоламины, тироксин, меланины, и ка-таболизируется до СО2 и Н2О. Катаболизм тирозина в печени В печени происходит катаболизм тирозина до конечных продуктов. Специфический путь катаболизма включает несколько ферментативных реакций, завершающихся образованием фумарата и ацетоацетата (см. схему А на с. 507): Трансаминирование тирозина с ос-кетоглутаратом катализирует тирозинаминотрансфе-раза(кофермент ПФ) - индуцируемый фермент печени млекопитающих. В результате образуется п-гидроксифенилпируват. В реакции окисления п-гидроксифенилпирувата в гомогентизиновую кислоту происходит декарбоксилирование, гидроксилирование ароматического кольца и миграция боковой цепи. Реакцию катализирует фермент п-гидроксифенилпируватдиоксигеназа, кофакторами которого выступают витамин С и Fe2+. Превращение гомогентизиновой кислоты в фумарилацетоацетат сопровождается расщеплением ароматического кольца. Эта реакция катализируется диоксигеназой гомогентизиновой кислоты, в качестве кофермента содержащей Fe2+. Обмен фенилаланина и тирозина связан со значительным количеством реакций гидроксилирования, которые катализируют оксигеназы. Ферменты оксигеназы (гидроксилазы) используют молекулу О2 и кофермент-донор водорода (чаще - Н4БП). Для катализа оксигеназам не-
Рис. 9-28. Пути превращения фенилаланина и тирозина в разных тканях. Н4БП - тетрагидробиоптерин; Н2БП - дигидробиоптерин; ПФ - пиридоксальфосфат; SAM - S-аденозилметионин. обходимы кофакторы - Fe2+ или гем (для некоторых - Сu+), а для многих ещё и витамин С. Оксигеназы делят на 2 группы: Монооксигеназы - один атом О2 присоединяют к продукту реакции, другой используют для образования Н2О; Диоксигеназы - оба атома О2 используют для образования продукта реакции. Почти все процессы расщепления ароматических колец в биологических системах катализируются диоксигеназами, подклассом ферментов, открытым японским биохимиком Осами Хайяши. В результате разрыва бензольного кольца образуется малеилацетоацетат, который в процессе цис- и транс-изомеризации превращается в фумарилацетоацетат. Гидролиз фумарилацетоацетата при действии фумарилацетоацетатгидролазы приводит к образованию фумарата и ацетоацетата.
Рис. 9-29. Реакции гидроксилирования фенилаланина (1) и регенерации Н4БП (2).
Схема А
Фумарат может окисляться до СО2 и Н2О или использоваться для глюконеогенеза. Ацетоацетат - кетоновое тело, окисляемое до конечных продуктов с выделением энергии. Превращение тирозина в меланоцитах В пигментных клетках (меланоцитах) тирозин выступает предшественником тёмных пигментов - меланинов. Среди них преобладают 2 типа: эумеланины и феомеланины. Эумеланины (чёрного и коричневого цвета) - нерастворимые высокомолекулярные гетерополимеры 5,6-дигидроксииндола и некоторых его предшественников. Феомеланины - жёлтые или красновато-коричневые полимеры, растворимые в разбавленных щелочах. Находятся они, в основном, в составе волос. Меланины присутствуют в сетчатке глаз. Цвет кожи зависит от распределения меланоцитов и количества в них разных типов меланинов. Синтез меланинов - сложный, многоступенчатый, разветвлённый процесс. Краткая схема синтеза представлена на рис. 9-28. Первую реакцию - превращение тирозина в ДОФА - катализирует тирозиназа, использующая в качестве кофактора ионы Сu+ (см. схему А на с. 509). Превращение тирозина в щитовидной железе В щитовидной железе синтезируются и выделяются гормоны йодтиронины: тироксин (тет-райодтиронин) и трийодтиронин. Эти гормоны представляют собой йодированные остатки тирозина, которые попадают в клетки щитовидной железы через базальную мембрану (см. раздел 11).
Превращения тирозина в надпочечниках и нервной ткани (синтез катехоламинов) В мозговом веществе надпочечников и нервной ткани тирозин является предшественником катехоламинов (дофамина, норадреналина и адреналина) (см. схему Б на с. 509). При образовании катехоламинов, которое происходит в нервной ткани и надпочечниках, и меланина в меланоцитах промежуточным продуктом служит диоксифенилаланин (ДОФА) . Однако гидроксилирование тирозина в клетках различных типов катализируется различными ферментами: Тирозиназа в меланоцитах является Сu+-зависимым ферментом (см. выше). Тирозингидроксилаза (1) в надпочечниках и ка-техоламинергических нейронах не нуждается в ионах меди. Это - Fе2+-зависимый фермент, аналогично фенилаланингидроксилазе в качестве кофермента использующий Н4БП. Физиологическая роль тирозингидроксилазы чрезвычайно велика, так как этот фермент является регуляторным и определяет скорость синтеза катехоламинов. Активность тирозингидроксилазы значительно изменяется в результате: Аллостерической регуляции (ингибитор - норадреналин); Фосфорилирования/дефосфорилирования: в результате фосфорилирования с участием протеинкиназы А снижаются Кm для кофермента Н4БП и сродство фермента к норадреналину, в результате чего происходит активация тирозингидроксилазы. Количество фермента регулируется на уровне транскрипции. ДОФА-декарбоксилаза (2) (кофермент - ПФ) катализирует образование дофамина, который при участии дофамингидроксилазы (3) (монооксигеназы) превращается в норадреналин. Для функционирования фермента необходимы ионы Сu+, витамин С и тетрагидробиоптерин. В мозговом веществе надпочечников фенилэтаноламин-N-метилтрансфераза (4) катализирует метилирование норадреналина, в результате чего образуется адреналин. Источником метальной группы служит &АМ. Дофамин и норадреналин служат медиаторами в синаптической передаче нервных импульсов,
Схема А
Схема Б
а адреналин - гормон широкого спектра действия, регулирующий энергетический обмен. Одна из функций катехоламинов - регуляция деятельности ССС (см. раздел 11).
59.Алкаптонурия ("чёрная моча") Причина заболевания - дефект диоксигеназы гомогентизиновой кислоты (рис. 9-28). Для этой болезни характерно выделение с мочой большого количества гомогентизиновой кислоты, которая, окисляясь кислородом воздуха, образует тёмные пигменты алкаптоны. Это метаболическое нарушение было описано ещё в XVI веке, а само заболевание охарактеризовано в 1859 г. Клиническими проявлениями болезни, кроме потемнения мочи на воздухе, являются пигментация соединительной ткани (охроноз) и артрит. Частота - 2-5 случаев на 1 млн новорождённых. Заболевание наследуется по аутосомнорецессивному типу. Диагностических методов выявления гетерозиготных носителей дефектного гена к настоящему времени не найдено. Альбинизм Причина метаболического нарушения - врождённый дефект тирозиназы. Этот фермент катализирует превращение тирозина в ДОФА в меланоцитах. В результате дефекта тирозиназы нарушается синтез пигментов меланинов. Клиническое проявление альбинизма (от лат. albus - белый) - отсутствие пигментации кожи и волос. У больных часто снижена острота зрения, возникает светобоязнь. Длительное пребывание таких больных под открытым солнцем приводит к раку кожи. Частота заболевания 1:20 000. Нарушение синтеза катехоламинов (рис. 9-28) может вызывать различные нервно-психические заболевания, причём патологические отклонения наблюдаются как при снижении, так и при увеличении их количества. Болезнь Паркинсона Заболевание развивается при недостаточности дофамина в чёрной субстанции мозга. Это одно из самых распространённых неврологических заболеваний (частота 1:200 среди людей старше 60 лет). При этой патологии снижена активность тирозингидроксилазы, ДОФА-декарбоксилазы. Заболевание сопровождается тремя основными симптомами: акинезия (скованность движений), ригидность (напряжение мышц), тремор (непроизвольное дрожание). Дофамин не проникает через гематоэнцефалический барьер и как лекарственный препарат не используется. Для лечения паркинсонизма предлагаются следующие принципы: заместительная терапия препаратами-предшественниками дофамина (производными ДОФА) - леводопа, мадопар, наком и др. подавление инактивации дофамина ингибиторами МАО (депренил, ниаламид, пиразидол и др.). Депрессивные состояния часто связаны со снижением в нервных клетках содержания дофамина и норадреналина. Гиперсекреция дофамина в височной доле мозга наблюдается при шизофрении.
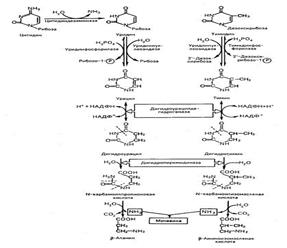
Распад нуклеиновых к-т Полимерные молекулы нуклеиновых кислот расщепляются в тканях преимущественно гидролитическим путем при участии специфических ферментов, относящихся к нуклеазам. Различают эндонуклеазы, разрывающие внутренние межнуклеотидные связи в молекулах ДНК и РНК, вызывающие деполимеризацию нуклеиновых кислот с образованием олигонуклеотидов, и экзонуклеазы, катализирующие гидролитическое отщепление концевых мононуклеотидов от ДНК и РНК или олигонуклеотидов. Имеются также ферменты, катализирующие распад нуклеиновых кислот, например, посредством трансферазной реакции. Известно несколько групп нуклеаз. Дезоксирибонуклеазы I катализируют разрыв внутренних фосфодиэфирных связей в одной из двух цепей молекулы ДНК между Дезоксирибонуклеазы II вызывают деполимеризацию молекулы ДНК в результате парных разрывов фосфодиэфирных связей обеих цепей ДНК с образованием более крупных олигодезоксирибонуклеотидов. Рестриктазы – ферменты ДНК-азного типа действия – катализируют распад чужеродной (в основном фаговой) ДНК в строго определенных участках молекулы. Рестриктазы оказывают строго специфическое действие, поэтому они используются для расшифровки последовательности нуклеотидных остатков в ДНК фагов и вирусов и находят широкое применение в генетической инженерии при создании рекомбинантных геномов. Распад пуриновых нуклеозидов.Образовавшиеся при гидролизе пуриновые нуклеозиды – аденозин и гуанозин – подвергаются ферментативному распаду в организме животных. Распад активно протекает в печени, почках, слизистой кишечника. Конечным продуктом пуринового обмена у человека, приматов, большинства животных является мочевая кислота. У части рептилий и некоторых млекопитающих мочевая кислота расщепляется до аллонтаина и у рыб – до аллантоиновой кислоты и мочевины.
Распад пиримидиновых нуклеозидов. Распад пиримидиновых нуклеотидов начинается с превращения нуклеотидов в нуклеозиды, а затем в свободные азотистые основания – урацил и тимин. Распад тимина и урацила приводят к образованию b-аланина и b-аминоизомасляной кислоты. Конечными продуктами реакции распада являются также СО2, NH3, мочевина.
КАТАБОЛИЗМ ПУРИНОВЫХ НУКЛЕОТИДОВ У человека основной продукт катаболизма пуриновых нуклеотидов - мочевая кислота. Её образование идёт путём гидролитического отщепления фосфатного остатка от нуклеотидов с помощью нуклеотидаз или фосфатаз, фосфоролиза N-гликозидной связи нуклеозидов пуриннуклеозидфосфорилазой, последующего дезами-нирования и окисления азотистых оснований (рис. 10-9). От АМФ и аденозина аминогруппа удаляется гидролитически аденозиндезаминазой с образованием ИМФ или инозина. ИМФ и ГМФ превращаются в соответствующие нуклеозиды: инозин и гуанозин под действием 5´-нуклеотидазы. Пуриннуклеозидфосфорилаза катализирует расщепление N-гликозидной связи в инозине и гуанозине с образованием рибозо-1-фосфата и азотистых оснований: гуанина и гипоксантина. Гуанин дезаминируется и превращается в ксантин, а гипоксантин окисляется в ксантин с помощью ксантиноксидазы, которая катализирует и дальнейшее окисление ксантина в мочевую кислоту. Ксантиноксидаза - аэробная оксидоредуктаза, простетическая группа которой включает ион молибдена, железа (Fe3+) и FAD. Подобно другим оксидазам, она окисляет пурины молекулярным кислородом с образованием пероксида водорода. В значительных количествах фермент обнаруживается только в печени и кишечнике. Мочевая кислота удаляется из организма главным образом с мочой и немного через кишечник с фекалиями. У всех млекопитающих, кроме приматов и человека, имеется фермент уриказа, расщепляющий мочевую кислоту с образованием аллантоина, хорошо растворимого в воде (рис. 10-10). Амфибии, птицы и рептилии, подобно человеку, лишены уриказы и экскретируют мочевую
Рис. 10-9. Катаболизм пуриновых нуклеотидов до мочевой кислоты. кислоту и гуанин в качестве конечных продуктов обмена. Мочевая кислота является слабой кислотой. Содержание недиссоциированной формы и солей (уратов) зависит от рН раствора. При физиологических значениях рН у мочевой кислоты может диссоциировать только один протон из трёх (рК = 5,8), поэтому в биологических жидкостях присутствует как недиссоциированная кислота в комплексе с белками, так и её натриевая соль. В сыворотке крови в норме содержание мочевой кислоты составляет 0,15-0,47 ммоль/л или 3-7 мг/дл. Ежесуточно из организма выводится от 0,4 до 0,6 г мочевой кислоты и уратов. НАРУШЕНИЯ ОБМЕНА ПУРИНОВЫХ НУКЛЕОТИДОВ Ураты значительно более растворимы, чем мочевая кислота: так, в моче с рН 5,0, когда
Аллантоин Рис. 10-10. Превращение мочевой кислоты в аллантоин. мочевая кислота не диссоциирована, ее растворимость в 10 раз меньше, чем в моче с рН 7,0, при котором основная часть мочевой кислоты представлена солями. Реакция мочи зависит от состава пищи, но, как правило, она слабокислая, поэтому большинство камней в мочевыводящей системе - кристаллы мочевой кислоты. А. Гиперурикемия подагры Когда в плазме крови концентрация мочевой кислоты превышает норму, то возникает гиперурикемия. Вследствие гиперурикемии может развиться подагра - заболевание, при котором кристаллы мочевой кислоты и уратов откладываются в суставных хрящах, синовиальной оболочке, подкожной клетчатке с образованием подагрических узлов, или тофусов. К характерным признакам подагры относят повторяющиеся приступы острого воспаления суставов (чаще всего мелких) - так называемого острого подагрического артрита. Заболевание может прогрессировать в хронический подагрический артрит. Поскольку лейкоциты фагоцитируют кристаллы уратов, то причиной воспаления является разрушение лизосомальных мембран лейкоцитов кристаллами мочевой кислоты. Освободившиеся лизосомальные ферменты выходят в иитозоль и разрушают клетки, а продукты клеточного катаболизма вызывают воспаление. Общий фонд сывороточных уратов в норме составляет ~ 1,2 г у мужчин и 0,6 г у женщин. При подагре без образования тофусов (т.е. подагрических узлов, в которых накапливаются ураты натрия и мочевая кислота) количество уратов возрастает до 2-4 г, а у пациентов с тяжёлой формой болезни, сопровождающейся ростом тофусов, может достигать 30 г. Подагра - распространённое заболевание, в разных странах ею страдают от 0,3 до 1,7% населения. А поскольку сывороточный фонд уратов у мужчин в 2 раза больше, чем у женщин, то они и болеют в 20 раз чаще, чем женщины. Как правило, подагра генетически детерминирована и носит семейный характер. Она вызвана нарушениями в работе ФРДФ синтетазы или ферментов "запасного" пути: гипоксантин-гуанин- или аденинфосфорибозилтрансфераз. К другим характерным проявлениям подагры относят нефропатию, при которой наблюдают образование уратных камней в мочевыводящих путях. Полиморфные варианты ФРДФ синтетазы Активность ФРДФ синтетазы, катализирующей образование ФРДФ, строго контролируется пуриновыми нуклеотидами. Мутации в гене ФРДФ синтетазы привели к появлению полиморфных вариантов фермента, которые характеризуются аномальным ответом на обычные регуляторные факторы: концентрацию рибозо-5-фосфата и пуриннуклеотидов. Как правило, наблюдаетсясуперактивация фермента. Пуриновые нуклеотиды синтезируются со скоростью, почти независимой от нужд клетки. Это вызывает ингибирование запасных "путей спасения", усиление катаболизма избыточного количества нуклеотидов, повышение продукции мочевой кислоты, гиперурикемию и подагру (табл. 10-1). Примерно у 40% больных одной из форм гликогеноза - болезнью Гирке (недостаточностью глюкозо-6-фосфатазы) сопутствующей патологией является подагра. Снижение способности печени секретировать глюкозу в кровь увеличивает использование глюкозо-6-фосфата в пентозофосфатном пути. Образуются большие количества рибозо-5-фосфата, которые могут стимулировать избыточный синтез, а следовательно, и катаболизм пуриновых нуклеотидов. Основным препаратом, используемым для лечения гиперурикемии, является аллопуринол - структурный аналог гипоксантина (рис. 10-11).
Рис. 10-11. Строение аллопуринола и гипоксантина. Аллопуринол оказывает двоякое действие на обмен пуриновых нуклеотидов:
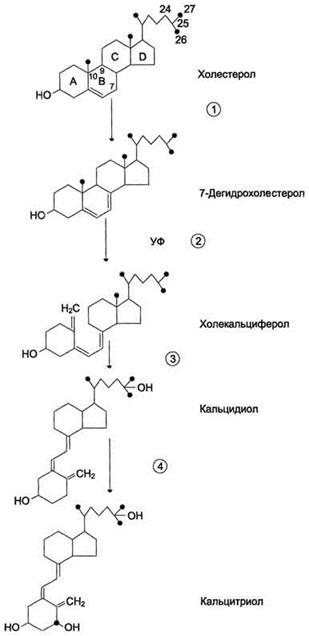
70.концентрация Глю в артериал крови 60-100 мг/длитр (3,3-5,5 ммоль/л).ее регулируют Гликолиз,Гликонеогенез,Гликогенолиз. После приёма углеводной пищи уровень глюкозы возрастает в течение примерно 1 ч до 150 мг/дл. 71.В виде фосфатных солей в костях находится лишь 1% кальция, который может легко обмениваться и играть роль буфера при изменениях концентрации кальция в плазме крови. Схема синтеза кальцитриола. 1 - холестерол является предшественником кальцитриола; 2 - в коже 7-дегидрохолестерол неферментативно превращается в холекальциферол; 3 - в печени 25-гидроксилаза превращает холекальциферол в кальцидиол; 4 - в почках образование кальцитриола катализируется 1α-гидроксилазой. Кальцитонин - антагонист паратгормона. Он ингибирует высвобождение Са2+ из кости, снижая активность остеокластов. Кроме того, кальцитонин подавляет канальцевую реабсорбцию ионов кальция в почках, тем самым стимулируя их экскрецию почками с мочой. Скорость секреции кальцитонина у женщин сильно зависит от уровня эстрогенов. При недостатке эстрогенов секреция кальцитонина снижается. Это вызывает ускорение мобилизации кальция из костной ткани, что приводит к развитию остеопороза.
72.Йодтиронины синтезируются в составе белка тиреоглобулина (Тг) в фолликулах, которые представляют собой морфологическую и функциональную единицу щитовидной железы. 73.Стероидные гормоны — группа физиологически активных веществ (половые гормоны, кортикостероиды и др.), регулирующих процессы жизнедеятельности у животных и человека. Глюкокортикоиды, С21-стероиды, играют важную роль в адаптации к стрессу. Они оказывают разнообразные эффекты, но наиболее важный - стимуляция глюконеогенеза (см. раздел 7). Основной глюкокортикоид человека - кортизол. Общим предшественником кортикостероидов служит холестерол. Кортизол стимулирует образование глюкозы в печени, усиливая глюконеогенез и одновременно увеличивая скорость освобождения аминокислот; стимулирует синтез гликогена в печени и тормозит потребление глюкозы периферическими тканями.
Синтез минералокортикоидов в клетках клубочковой зоны коры надпочечников также начинается с превращения холестерола в прегненолон, а затем в прогестерон. Основным местом синтеза женских половых гормонов – эстрогенов (от греч. oistros – страстное влечение) – являются яичники и желтое тело; доказано также образование этих гормонов в надпочечниках, семенниках и плаценте. Женские гормоны:
Мужские гормоны. Биосинтез андрогенов осуществляется главным образом в семенниках и частично в яичниках и надпочечниках. Основными источниками и предшественниками андрогенов, в частности тестостерона, являются уксусная кислота и холестерин.
Анаболические средства — вещества, действие которых направлено на усиление анаболических процессов в организме, то есть вещества, ускоряющие образование и обновление структурных частей клеток, тканей и мышечных структур. Терапевтическое действие выражается в повышении аппетита, ускорении регенеративных процессов, а также увеличении массы тела. При курсовом употреблении увеличивается мышечная масса, снижается процент жировых отложений в организме. Наблюдается фиксация кальция и фосфора в зубах и костях, повышается общая выносливость, работоспособность. Улучшается функциональное состояние головного мозга. Улучшается кровенаполненность сосудов и оксигенация тканей.
74.кровь-жидкий компонент соединительной ткани,присущий высш многоклеточным. Функции крови: регуляторная. Транспортная( дыхательная,питательная,выделительная). Защитная(иммунная и гемостаз). Гомеостатическая (буферная(постоянство рН),температурная,электролитическая(постоянство минерал состава),онкотическая). Парапротеинемия-появление аномальных белков. а)Миелонная болезнь-злокач опухоль(плазмоциты синтезируют L-цепь в 100р больше). Б)Болезнь Вальденстрема-накопление макроглобулинов. 75.Антигены представляют собой чужеродные вещества или структуры, которые способны вызывать иммунный ответ. ТКАНЕВАЯ НЕСОВМЕСТИМОСТЬ, иммунная реакция организма, направленная против чужеродных клеток (тканей) и вызванная различиями их антигенного состава. В основе механизма несовместимости тканей лежит реакция антител организма-хозяина на антигены клеточных мембран пересаживаемой или вводимой ткани. Результаты тканевой несовместимости – отторжение пересаженной ткани или органа, осложнения при переливании крови и беременности. Для преодоления этих последствий при подборе пары донор – реципиент учитывают их совместимость по антигенному составу ткани и группам крови. После пересадки реципиенту назначают иммунодепрессанты, подавляющие активность иммунных клеток и образование антител. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|