|
|
Декарбоксилирование аминокислот, образование биогенных аминов: гистамина, триптамина, серотонина, ГАМК. Роль биогенных аминов в регуляции метаболизма и функции. Инактивация биогенных аминов.Большую роль в организме человека играют непептидные азотсодержащие соединения - производные аминокислот. К ним можно отнести гормоны надпочечников (норадреналин, адреналин), щитовидной железы (тироксин, трийодтиронин), а также медиаторы ЦНС (ацетилхолин, ГАМК и др.), медиатор воспаления (гистамин) и другие соединения.
А. Декарбоксилирование аминокислот и их производных
Некоторые аминокислоты и их производные могут подвергаться декарбоксилированию - отщеплению ос-карбоксильной группы. В тканях млекопитающих декарбоксилированию может подвергаться целый ряд аминокислот или их производных: Три, Тир, Вал, Гис, Глу, Цис, Apr, Орнитин, SAM, ДОФА, 5-окситриптофан и др. Продуктами реакции являются СО2 и амины, которые оказывают выраженное биологическое действие на организм (биогенные амины): Реакции декарбоксилирования необратимы и катализируются ферментами декарбоксилазами. Простетическая группа декарбоксилаз в клетках животных - пиридоксальфосфат. Серотонин - нейромедиатор проводящих путей. Образуется в надпочечниках и ЦНС из аминокислоты 5-гидрокситриптофана в результате действия декарбоксилазы ароматических аминокислот. Серотонин может превращаться в гормон мелатонин, регулирующий суточные и сезонные изменения метаболизма организма и участвующий в регуляции репродуктивной функции. Серотонин - биологически активное вещество широкого спектра действия. Он стимулирует сокращение гладкой мускулатуры, оказывает сосудосуживающий эффект, регулирует АД, температуру тела, дыхание, обладает антидепрессантным действием. По некоторым данным он может принимать участие в аллергических реакциях, поскольку в небольших количествах синтезируется в тучных клетках. В нервных клетках декарбоксилирование глутамата (отщепление α-карбоксильной группы) приводит к образованию γ-аминомасляной кислоты (ГАМК), которая служит основным тормозным медиатором высших отделов мозга. Цикл превращений ГАМК в мозге включает три сопряжённые реакции, получившие название ГАМК-шунта. Первую катализирует глутаматдекарбоксилаза, которая является пиридоксальзависимым ферментом. Эта реакция является регуляторной и обусловливает скорость образования ГАМК в клетках мозга. Продукт реакции - ГАМК. Последующие 2 реакции можно считать реакциями катаболизма ГАМК. ГАМК-аминотрансфераза, также пиридоксальзависимая, образует янтарный полуальдегид, который затем подвергается дегидрированию и превращается в янтарную кислоту. Сукцинат используется в цитратном цикле. Инактивация ГАМК возможна и окислительным путём под действием МАО. Она увеличивает проницаемость постсинаптических мембран для ионов К+, что вызывает торможение нервного импульса; повышает дыхательную активность нервной ткани; улучшает кровоснабжение головного мозга.
Гистамин образуется путем декарбоксилирования гистидина в тучных клетках соединительной ткани.Гистамин образует комплекс с белками и сохраняется в секреторных гранулах тучных клеток. Секретируется в кровь при повреждении ткани (удар, ожог, воздействие эндо- и экзогенных веществ), развитии иммунных и аллергических реакций. Гистамин выполняет в организме человека следующие функции: стимулирует секрецию желудочного сока, слюны (т.е. играет роль пищеварительного гормона); повышает проницаемость капилляров, вызывает отёки, снижает АД (но увеличивает внутричерепное давление, вызывает головную боль); сокращает гладкую мускулатуру лёгких, вызывает удушье; участвует в формировании воспалительной реакции - вызывает расширение сосудов, покраснение кожи, отёчность ткани; вызывает аллергическую реакцию; выполняет роль нейромедиатора; является медиатором боли. Триптамин образуется декарбоксилированием триптофана. Возбуждающий медиатор средних отделов мозга Инактивация биогенных аминов происходит двумя путями: 1) метилированием с участием SAM под действием метилтрансфераз. Таким образом могут инактивироваться различные биогенные амины, но чаще всего происходит инактивация гастамина и адреналина. Так, инактивация адреналина происходит путём метилирования гидроксильной группы в ортоположении (см. схему ниже). Реакция инактивации гистамина также преимущественно происходит путём метилирования. 2) окислением ферментами моноаминооксидазами (МАО) с коферментом FAD - таким путем чаще происходит инактивация дофамина, норадреналина, серотонина, ГАМК. При этом происходит окислительное дезаминирование биогенных аминов с образованием альдегидов, а затем соответствующих кислот, которые выводятся почками Обмен серина и глицина Серин - заменимая аминокислота, синтезируется из промежуточного продукта гликолиза - 3-фосфоглицерата, а аминогруппу получает от глутаминовой кислоты. Глицин - также заменимая аминокислота, основным источником которой служит серии. Реакцию синтеза глицина из серина катализирует фермент серин-оксиметилтрансфераза, кофермен-том которой является Н4-фолат (см. схему А). Реакция превращения серина в глицин легко обратима. Основной путь катаболизма глицина у человека и других позвоночных также связан с использованием Н4-фолата (см. схему Б). Эта реакция обратима и катализируется глицинсинтазой - ферментным комплексом, похожим на пируватдегидрогеназный комплекс, и локализованным в митохондриях клеток печени. По последним данным глицинрасщепляющая ферментная система несколько отличается от глицинсинтазы и содержит 4 белка: Р-белок, включающий кофермент ПФ, Н-белок, содержащий липоевую кислоту, Т-белок с коферментом Н4-фолат, L-белок, являющийся дигидролипоилдегидрогеназой с коферментом NAD+. 1. Пути метаболизма серина и глицина Аминокислоты серии и глицин выполняют в организме человека разнообразные и очень важные функции. Роль серина и глицина в синтезе многих биологически важных соединений представлена на рис. 9-24.
Схема А
Схема Б
Рис. 9-24. Биологическая роль серина и глицина. На рисунке видно, что обе аминокислоты необходимы не только для синтеза белков и глюкозы (при её недостатке в клетках), но и нукле-отидов, коферментов, тема, сложных липидов, креатина и других соединений. Многие из этих реакций представлены в соответствующих разделах учебника. 3. Образование и использование Особое значение реакций катаболизма серина и глицина заключается в том, что они сопровождаются образованием одноуглеродного
Схема А
Схема Б
Схема В
метиленового фрагмента (-СН2-). Метиленовая группа в молекуле метилен- Н4-фолата может превращаться в другие одноуглеродные группы (фрагменты): метенильную (-СН=), формильную (-НС=О), метильную (-СН3) и формиминогруппу (-CH=NH) (рис. 9-25). Ещё один источник формального и форми-мино-фрагментов - гистидин. Катаболизм гистидина происходит только в печени (очень небольшой процент в коже) в результате следующих реакций (см. схему на с. 498). Конечными продуктами катаболизма гистидина являются глутамат, NH3 и одноуглеродные фрагменты - формимино-Н4-фолат и формил-Н4-фолат. Все образующиеся производные Н4-фолата играют роль промежуточных переносчиков и служат донорами одноуглеродных фрагментов при синтезе некоторых соединений: пуриновых оснований и тимидиловой кислоты (необходимых для синтеза ДНК и РНК), регенерации метионина, синтезе различных
Рис. 9-25. Образование производных Н4-фолата. формиминопроизводных (формиминоглицина и т.д.) (рис. 9-26). Перенос одноуглеродных фрагментов к акцептору необходим не только для синтеза ряда соединений, но и для регенерации свободного Н4-фолата в печени. 4. Недостаточность фолиевой кислоты Недостаточность фолиевой кислоты у человека возникает редко (см. раздел 3). Гиповитаминоз фолиевой кислоты приводит к нарушению обмена одноуглеродных фрагментов. Такое же нарушение наблюдается и при недостаточности витамина В12, использование которого связано с обменом фолиевой кислоты (см. подраздел IX). Первое проявление дефицита фолиевой кислоты - мегалобластная (макроцитарная) анемия. Она характеризуется уменьшением количества эритроцитов, снижением содержания в
Схема
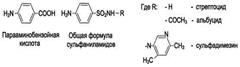
Рис. 9-26. Образование и использование производных Н4-фолата. них гемоглобина, что вызывает увеличение размера эритроцитов. Причина этих симптомов - нарушение синтеза ДНК и РНК из-за недостатка их предшественников - тимидиловой кислоты и пуриновых нуклеотидов вследствие дефицита производных Н4-фолата. Клетки кроветворной ткани быстро делятся, поэтому они в первую очередь реагируют на нарушение синтеза нуклеиновых кислот снижением скорости эритропоэза. Мегалобластная анемия возникает чаще всего в результате недостаточности фолиевой кислоты и/или витамина В12. 5. Механизм антибактериального действия Фолиевая кислота является витамином для человека и животных. Однако многие патогенные бактерии способны синтезировать это соединение, используя парааминобензойную кислоту (ПАБК) - одну из составных частей фолата. ПАБК поступает в бактериальные клетки из внешней среды. Сульфаниламидные лекарственные препараты - производные сульфаниламида (белого стрептоцида), похожи по строению на парааминобензойную кислоту. Отличаются они только радикалами (см. схему на с. 499).
Схема
Эти препараты подавляют синтез фолиевой кислоты у бактерий, потому что: конкурентно ингибируют бактериальные ферменты синтеза фолата, так как являются структурными аналогами парааминобензойной кислоты - одного из субстратов процесса; могут использоваться как псевдосубстраты из-за относительной субстратной специфичности ферментов, в результате чего синтезируется соединение, похожее на фолиевую кислоту, но не выполняющее её функции. В обоих случаях в клетках бактерий нарушается обмен одноуглеродных фрагментов и, следовательно, синтез нуклеиновых кислот, что вызывает прекращение размножения бактерий. В клетках больного сульфаниламидные лекарственные вещества не вызывают подобных изменений, поскольку человек получает с пищей готовую фолиевую кислоту.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|