|
|
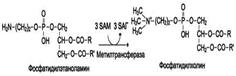
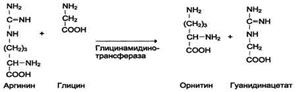
Обмен серосодержащих аминокислотВ состав белков человека входят 2 аминокислоты, содержащие серу, - метионин и цистеин. Эти аминокислоты метаболически тесно связаны между собой. 1. Особенности обмена метионина Метионин - незаменимая аминокислота. Она необходима для синтеза белков организма, участвует в реакциях дезаминирования, является источником атома серы для синтеза цистеина. Метионил-тРНК участвует в инициации процесса трансляции. Метальная группа метионина - мобильный одноуглеродный фрагмент, используемый для синтеза ряда соединений. Перенос метильной группы метионина на соответствующий акцептор называют реакцией трансметилирования, имеющей важное метаболическое значение. Метальная группа в молекуле метионина прочно связана с атомом серы, поэтому непосредственным донором этого одноутлеродного фрагмента служит активная форма аминокислоты. Реакция активация метионина Активной формой метионина является S-аденозилметионин (SAM) - сульфониевая форма аминокислоты, образующаяся в результате присоединения метионина к молекуле аденозина. Аденозин образуется при гидролизе АТФ (см. схему А). Эту реакцию катализирует фермент метионин аденозилтрансфераза, присутствующий во всех типах клеток. Структура (-S+-CH3) в SAM - нестабильная группировка, определяющая высокую активность метильной группы (отсюда термин "активный метионин"). Эта реакция уникальна для биологических систем, так как, по-видимому, является единственной известной реакцией, в результате которой освобождаются все три фосфатных остатка АТФ. Отщепление метильной группы от SAM и перенос её на соединение-акцептор катализируют ферменты метилтрансферазы. SAM в ходе реакции превращается в S-аденозилгомоцистеин (SAT). Примеры реакций трансметилирования Синтез фосфатидилхолина из фосфатидилэтиноламина Фосфатидилхолины (лецитины) - наиболее распространённая группа глицерофосфолипидов, участвующих в образовании мембран клеток и липопротеинов, в составе которых осуществляется транспорт липидов (см. раздел 8) (см. схему Б). Синтез карнитина Карнитин - переносчик жирных кислот через мембрану митохондрий (см. раздел 8) (см. схему А на с. 501). Синтез креатина Креатин необходим для образования в мышцах высокоэнергетического соединения - кре-атинфосфата. Синтез креатина идёт в 2 стадии с участием 3 аминокислот: аргинина, глицина и метионина. В почках образуется гуанидинацетат при действии глицинамидинотрансферазы (см. схему Б на с. 501). Затем гуанидинацетат транспортируется в печень, где происходит реакция его метилирования (см. схему В на с. 501).
Схема А
Схема Б
Схема А
Схема Б
Схема В
Креатин с кровотоком переносится в мышцы и клетки мозга, где из него образуется высокоэнергетическое соединение - креатинфосфат. (см. схему А на с. 502). Эта реакция легко обратима и катализируется ферментом креатинкиназой. Фермент локализован в цитозоле и митохондриях клеток, обладает органоспецифичностью. В норме активность его в крови очень мала. Обнаружено три изоферментные формы креатинкиназы (см. раздел 2). Креатинфосфат играет важную роль в обеспечении энергией работающей мышцы в начальный период. В результате неферментативного дефосфорилирования, главным образом в мышцах, креатинфосфат превращается в креатинин, выводимый с мочой. Суточное выделение кре-атинина у каждого индивидуума постоянно и пропорционально общей мышечной массе (см. схему Б на с. 502). Определение содержания креатина и креати-нина в крови и моче используется для характеристики интенсивности работы мышц в спортивной медицине и при некоторых патологических состояниях. Определение активности фермента креатинкиназы и его изоферментных форм в
Схема A
Схема Б
крови используется в медицине для диагностики таких заболеваний, как инфаркт миокарда, миопатии, мышечные дистрофии и др. Реакции трансметилирования используются также для: синтеза адреналина из норадреналина; синтеза анзерина из карнозина; метилирования азотистых оснований в нук-леотидах и др. (см. раздел 10); инактивации метаболитов (гормонов, медиаторов и др.) и обезвреживания чужеродных соединений, включая и лекарственные препараты (см. подразд. IX, раздел 12). Регенерация метионина Реакции метилирования играют важную роль в организме и протекают очень интенсивно. Это вызывает большой расход метионина, так как он является незаменимой аминокислотой (в клетках метионин синтезироваться не может). В связи с этим большое значение приобретает возможность регенерации метионина с участием заменимых аминокислот (Сер, Гли). В результате отщепления метильной группы SAM превращается в S-аденозилгомоцистеин (SAT), который при действии гидролазы расщепляется на аденозин и гомоцистеин. S-аденозилгомоцистеин + Н2О → Аденозин + Гомоцистеин Гомоцистеин может снова превращаться в ме тионин под действием гомоцистеинметилтранс феразы. Донором метильной группы в этом слу чае служит N5-метил-Н4-фолат:
Промежуточным переносчиком метильной группы в этой реакции служит производное витамина В12 - метилкобаламин, выполняющий роль кофермента. Метионин - незаменимая аминокислота, однако может регенерироваться из гомоцистеина. Следовательно, незаменим именно гомоцистеин, но единственным его источником в организме служит метионин. В пище гомоцистеина крайне мало, поэтому потребности человека в метиони-не и гомоцистеине обеспечиваются только мети-онином пиши. Общая схема метаболизма метионина, связанная с обменом одноуглеродных фрагментов, представлена на рис. 9-27. Первичным донором одноуглеродныхкфраг-ментов является серии. Образовавшийся N5,N10-метилен-Н4-фолат восстанавливается до N5-метил-Н4-фолата, передающего метильную группу на кобаламин (витамин В12). Метилкобаламин непосредственно участвует в регенерации метионина. Гомоцистеин может использоваться также для синтеза цистеина.
Рис. 9-27. Метаболизм метионина. 1 - реакции трансметилирования; 2 - синтез цистеина; 3 - регенерация метионина.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|