
|
|
Лабораторная работа № 2. «Определение содержания соды в присутствии щёлочи»Цель работы:определить содержание соды и щёлочи в пробе раствора при их совместном присутствии методом кислотно-основного титрования. Сущность работы. Раствор, содержащий гидроксид и карбонат натрия, титруют раствором соляной кислоты. В ходе титрования последовательно протекают следующие реакции: NaOH + HCl = NaCl + H2O (1); Na2CO3 + HCl = NaHCO3 + NaCl (2); NaHCO3 + HCl = H2CO3 + NaCl (3). Каждой реакции соответствует эквивалентная точка. Первую эквивалентную точку с помощью цветных индикаторов определить невозможно, так как скачок рН в ней мал и лежит в сильнощелочной области. Вторую эквивалентную точку, отвечающую полному протеканию реакции (2) и имеющую значение рН = 8,3, можно установить по обесцвечиванию розовой окраски индикатора фенолфталеина. Третьей эквивалентной точке соответствует значение рН = 3,8, которое соответствует переходу окраски метилоранжа от желтой к оранжевой. Оборудование и реактивы: бюретка объёмом 25 мл; мерная пипетка объёмом 5 мл; коническая колба для титрования объёмом 100-250 мл; химический стакан объёмом 50 мл; соляная кислота, 0,1 н. раствор; фенолфталеин; метилоранж; проба раствора для анализа. Выполнение работы 1. Из пробы раствора мерной пипеткой отобрать в коническую колбу для титрования аликвоту объёмом 5 мл. 2. Аликвоту разбавить дистиллированной водой до объёма 20-30 мл. 3. Добавить 2 капли фенолфталеина. 4. Залить в бюретку соляную кислоту, выпустить из носика бюретки воздух и довести уровень раствора до отметки «0». 5. Титровать из бюретки соляной кислотой до полного исчезновения розовой окраски. Окраска не должна восстанавливаться при перемешивании раствора в течение 30 секунд. 6. Записать эквивалентный объём V2. 7.Добавить 2-3 капли метилового оранжевого. 8. Не доливая бюретку до нуля, продолжать титрование до перехода жёлтой окраски раствора в оранжевую. 9. Записать эквивалентный объём V3. 10. Долить бюретку кислотой до нуля и повторить п.п. 1-9. Содержание протокола лабораторной работы Номер пробы. Объем аликвоты Va, мл. Концентрация соляной кислоты CHCl, экв/л. Объём соляной кислоты, расходованный на титрование c фенолфталеином: V1(HCl), мл; V2(HCl), мл; Vср(HCl)2, мл. Объём соляной кислоты, расходованный на титрование c метиловым оранжевым: V1(HCl), мл; V2(HCl), мл; Vср(HCl)3, мл. Обработка результатов эксперимента 1. Вычислить нормальную концентрацию соды и гидроксида натрия в растворе:
2. Выразить содержание соды и щелочи в растворе в г/л:
Для соды значение обменного эквивалента равно 2, для щелочи – 1. Лабораторная работа № 3. «Перманганатометрическое определение содержания железа (2+)» Цель работы: определение содержания железа (2+) в пробе раствора методом перманганатометрии. Сущность работы. Определение содержания железа (2+) основано на реакции:
Оборудование и реактивы: бюретка объёмом 25 мл; мерная пипетка объёмом 5 мл; коническая колба для титрования объёмом 100-250 мл; химический стакан объёмом 50 мл; мерный цилиндр объёмом 10-25 мл; фосфорная кислота, концентрированный раствор; перманганат калия, 0,1 н. раствор; проба раствора для анализа. Выполнение работы 1. В конические колбы для титрования мерной пипеткой отобрать аликвоты объёмом 5 мл. 2. К аликвотам мерного цилиндра добавить по 2 мл фосфорной кислоты и разбавить дистиллированной водой до объёма 20-30 мл. 3. Залить в бюретку перманганат калия, выпустить из носика бюретки воздух и довести уровень раствора до отметки «0». 4. Титровать из бюретки раствором перманганата калия до появления розовой окраски избыточного титранта, не исчезающей при перемешивании в течение 1 минуты. 5. Записать эквивалентный объём титранта. 6. Повторить титрование до получения не менее двух сходящихся значений. Содержание протокола лабораторной работы Номер пробы. Объем аликвоты Va, мл. Концентрация перманганата калия C(KMnO4), экв/л. Объём тиосульфата натрия, расходованный на титрование: V1(KMnO4), мл; V2(KMnO4), мл; Vср(KMnO4), мл. Обработка результатов эксперимента 1. Вычислить нормальную коцентрацию железа (II) в пробе раствора:
2. Выразить содержание железа (II) в растворе в г/л:

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
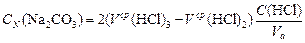 , экв/л.
, экв/л.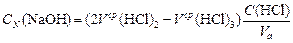 , экв/л.
, экв/л.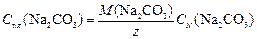 ;
; .
. От первой избыточной капли титранта появляется розовая окраска, по которой отмечают эквивалентную точку.
От первой избыточной капли титранта появляется розовая окраска, по которой отмечают эквивалентную точку. , экв/л.
, экв/л. .
.