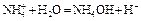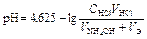|
|
Кривая титрования слабой одноосновной кислоты щёлочью1 этап. В растворе присутствует только слабая кислота и рН раствора определяется её концентрацией и константой диссоциации:
где СK – концентрация раствора кислоты, моль/л. 2 этап. Процесс титрования. Происходит постепенная нейтрализация кислоты щёлочью:
В результате образуется буферная смесь, состоящая из слабой кислоты, избыток которой присутствует в системе до точки эквивалентности и соли этой кислоты. рН вычисляется по уравнению для кислого буферного раствора:
где 3 этап. Точка эквивалентности. На нейтрализацию кислоты затрачен эквивалентный объём щёлочи VЭ. В системе находится только соль, гидролизующаяся по аниону. рН в точке эквивалентности будет больше 7 и вычисляется по уравнению:
Концентрация соли в точке эквивалентности:
где
4 этап. После точки эквивалентности рН определяется только количеством добавленной щёлочи:
Пример. Рассчитать кривую титрования 10 мл 0,1 н. уксусной кислоты 0,1 н. раствором гидроксида натрия.
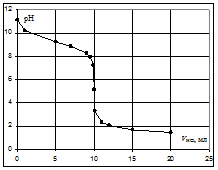
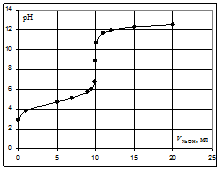
Кривая титрования слабой одноосновной кислоты щелочью При рассмотрении кривой титрования обращает внимание то, что точка эквивалентности лежит в щелочной области. Скачок значений рН вблизи эквивалентной точки меньше, чем в случае сильного электролита и не превышает двух единиц рН при добавлении одной капли титранта. Для титрования следует выбирать индикатор, изменяющий окраску в щелочной среде, в примере – при рН = 8-9. Таковым является фенолфталеин. Кривая титрования слабого однокислотного основания сильной кислотой 1 этап. В растворе присутствует только слабое основание и рН раствора определяется его концентрацией и константой диссоциации:
где Со – концентрация раствора слабого основания, моль/л. 2 этап. Процесс титрования. Происходит постепенная нейтрализация слабого основания кислотой:
В результате образуется буферная смесь, состоящая из слабого основания, избыток которого присутствует в системе до точки эквивалентности и соли этого основания. рН вычисляется по уравнению для основного буферного раствора:
где 3 этап. Точка эквивалентности. На нейтрализацию основания затрачен эквивалентный объём кислоты VЭ. В системе находится только соль, гидролизующаяся по катиону. рН в точке эквивалентности будет меньше 7 и вычисляется по уравнению:
Концентрация соли в точке эквивалентности:
где
4 этап. После точки эквивалентности рН определяется только количеством добавленной кислоты:
Пример. Рассчитать кривую титрования 10 мл 0,1 н. гидроксида аммония 0,1 н. раствором соляной кислоты.
Кривая титрования слабого основания сильной кислотой Кривая титрования слабого основания кислотой, например, раствора аммиака или его органического производного – амина, будет зеркальным отображением кривой титрования слабой одноосновной кислоты. Точка эквивалентности при этом окажется в кислой области. Для её определения необходим индикатор, изменяющий окраску в выбранном примере в области значений рН = 4-6, например, метиловый оранжевый. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 .
.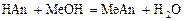 .
.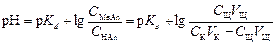 ,
, – концентрация соли слабой кислоты,
– концентрация соли слабой кислоты,  – остаточная концентрация слабой кислоты, VK – объём пробы кислоты, взятый для титрования, СЩ – концентрация раствора щёлочи, VЩ – объём раствора щёлочи, добавленный в процессе титрования.
– остаточная концентрация слабой кислоты, VK – объём пробы кислоты, взятый для титрования, СЩ – концентрация раствора щёлочи, VЩ – объём раствора щёлочи, добавленный в процессе титрования. .
.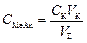 ,
, ‒ общий объём раствора в точке эквивалентности,
‒ общий объём раствора в точке эквивалентности, .
.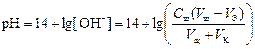 .
.
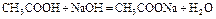

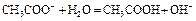


 .
. .
. ,
, – концентрация соли слабого основания,
– концентрация соли слабого основания,  – остаточная концентрация слабого основания, VО – объём пробы основания, взятый для титрования, Ск – концентрация раствора кислоты, VK – объём раствора кислоты, добавленный в процессе титрования.
– остаточная концентрация слабого основания, VО – объём пробы основания, взятый для титрования, Ск – концентрация раствора кислоты, VK – объём раствора кислоты, добавленный в процессе титрования. .
. ,
,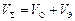 .
.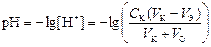 .
.