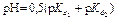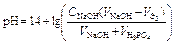|
|
Кривая титрования слабой многоосновной кислотыОсновное различие в расчетах кривой титрования одно- и многоосновных кислот связано со ступенчатой диссоциацией многоосновных кислот и, как следствие, с возможным существованием двух и более скачков титрования соответственно числу ступеней диссоциации. Возможность титрования кислоты с заданной точностью по первой точке эквивалентности зависит от соотношения ступенчатых констант диссоциации кислоты. Титрование кислоты состава H2An по первой ступени с погрешностью не более 1 % означает, что взаимодействие кислоты со щёлочью по первой ступени должно пройти не менее чем на 99 %, а по второй не более чем на 1 %. Такая ситуация возможна, если вторая константа диссоциации будет на 4 порядка меньше, чем первая. Если различие в константах диссоциации будет составлять 6 или более порядков, то погрешность определения может быть снижена до 0,1 % Участки кривой титрования многоосновной кислоты рассчитываются по тем же формулам, что и для одноосновной кислоты. Ниже рассмотрены этапы титрования слабой трёхосновной кислоты. 1 этап. В растворе присутствует только слабая кислота, рН раствора определяется её концентрацией и первой константой диссоциации:
где СK – концентрация раствора кислоты, моль/л. 2 этап. Процесс титрования. Происходит постепенная нейтрализация кислоты щёлочью по первой ступени:
В результате образуется буферная смесь, состоящая из слабой кислоты, избыток которой присутствует в системе до точки эквивалентности и кислой соли этой кислоты. рН вычисляется по уравнению для кислого буферного раствора:
где 3 этап. Первая точка эквивалентности. На нейтрализацию кислоты затрачен эквивалентный объём щёлочи
4 этап. Аналогичен второму этапу. Происходит нейтрализация кислоты щёлочью по второй ступени:
В результате образуется буферная смесь, состоящая из двух кислых солей. Более кислая соль будет играть роль кислоты, менее кислая – роль соли. рН вычисляется по уравнению для кислого буферного раствора:
5 этап. Вторая точка эквивалентности. На нейтрализацию кислоты затрачен эквивалентный объем щёлочи
6 этап. Нейтрализация кислоты по третьей ступени:
В результате образуется буферная смесь, состоящая из кислой и основной солей. Кислая соль будет играть роль кислоты, средняя – роль соли. рН вычисляется по уравнению для кислого буферного раствора:
7 этап. Третья точка эквивалентности. На нейтрализацию кислоты затрачен эквивалентный объём щёлочи
где 8 этап. После точки эквивалентности рН определяется только количеством добавленной щёлочи:
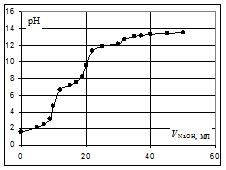
Расчёт кривой титрования 10 мл 0,1 н. раствора ортофосфорной кислоты 0,1 н. раствором гидроксида натрия.
Кривая титрования ортофосфорной кислоты щёлочью Следует отметить, что вследствие малой константы диссоциации кислоты по третьей ступени, на кривой титрования ортофосфорной кислоты можно выделить только 2 скачка значений рН, соответствующих двум эквивалентным точкам. Первую из них при рН около 4,7 удобно определять с помощью индикатора бромкрезолового зелёного по переходу окраски из жёлтой в голубую, вторую эквивалентную точку при рН в районе 9,6 можно определить с тимоловым голубым. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 ,
, .
. ,
, – концентрация кислой соли слабой кислоты,
– концентрация кислой соли слабой кислоты,  – остаточная концентрация слабой кислоты, VK – объём пробы кислоты, взятый для титрования, СЩ – концентрация раствора щёлочи, VЩ – объём раствора щёлочи, добавленный в процессе титрования.
– остаточная концентрация слабой кислоты, VK – объём пробы кислоты, взятый для титрования, СЩ – концентрация раствора щёлочи, VЩ – объём раствора щёлочи, добавленный в процессе титрования. . В системе находится только кислая соль MeH2An. рН вычисляется по уравнению:
. В системе находится только кислая соль MeH2An. рН вычисляется по уравнению: .
. .
. ,
, . В системе находится только кислая соль состава MeHx-2An. рН вычисляется по уравнению:
. В системе находится только кислая соль состава MeHx-2An. рН вычисляется по уравнению: .
.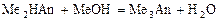 .
. .
. . В системе находится только средняя соль состава Me3An. рН вычисляется по уравнению для гидролизующейся по аниону соли:
. В системе находится только средняя соль состава Me3An. рН вычисляется по уравнению для гидролизующейся по аниону соли: ,
, ,
, .
. .
.