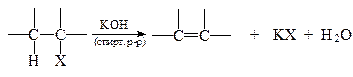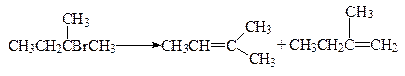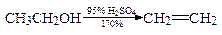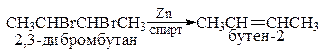|
|
Дегидрогалогенирование алкилгалогенидовРеакция дегидрогалогенирования - это отщепление гидрогалогенида, происходит под действием спиртового раствора щелочи.
Легкость дегидрогалогенирования уменьшается в ряду: третичные > вторичные > первичные алкилгалогениды. При переходе от первичного к вторичному и затем к третичному алкилгалогениду структура углеводорода становится более разветвленной у атома углерода, связанного с галогеном. Увеличение степени разветвленности приводит к появлению большего количества атомов водорода для атаки основанием и, следовательно, к увеличению вероятности элиминирования. Кроме того, в результате реакции образуется более разветвленный и более устойчивый алкен. Например,
Преобладающим продуктом является алкен, имеющий большее число алкильных групп, связанных с атомом углерода у двойной связи.
71% 29%
Легкость образования алкенов изменяется в ряду:
Интересно отметить, что устойчивость алкенов изменяется в такой же последовательности. Существует правило: чем устойчивее алкен, тем легче он образуется в реакции дегидрогалогенирования. Закономерности, наблюдаемые при образовании алкенов в реакциях дегидрогалогенирования алкилгалогенидов и дегидратации спиртов, были изучены русским ученым А.М. Зайцевым и называются правилами Зайцева (1875 г.): - в реакциях дегидрогалогенирования образуется наиболее замещенный, т.е. наиболее устойчивый алкен: - водород в реакции элиминирования отщепляется от наименее гидрогенизированного атома углерода.
Дегидратация спиртов Спирты превращаются в алкены дегидратацией, которая протекает в присутствии кислоты и при нагревании:
Дегидратацию обычно проводят, нагревая спирт с серной или фосфорной кислотой при температуре около 2000С, либо пропуская пары спирта над окисью алюминия AL2O3 при 350-4000С. Легкость дегидратации спиртов изменяется в ряду: третичные > вторичные > первичные спирты. Например,
Дегалогенирование вицинальных дигалогенидов Дегалогенирование вицинальных (от латинского vicinalis - соседний) дигалогенидов часто ограничено тем, что эти дигалогениды обычно получают из алкенов. Однако иногда удобно использовать превращение алкенов в дигалогениды, чтобы провести реакции с остальной частью молекулы и затем регенерировать алкен действием цинка; такая операция называется защитой двойной связи. Например:
Восстановление алкинов При восстановлении тройной углерод-углеродной связи до двойной возможно образование (если только тройная связь не находится на конце цепи) двух изомерных алкенов: цис- и транс-. Какой из изомеров будет преобладать, зависит от выбора восстанавливающего реагента. Цис-алкен образуется почти исключительно (до 90%) при гидрировании алкинов в присутствии некоторых катализаторов: платины, палладия или бромида никеля. Транс-алкен образуется предпочтительно при восстановлении алкинов натрием или никелем в жидком аммиаке.
Реакции, приводящие преимущественно к образованию одного из нескольких возможных стереоизомеров, называются стереоселективными. Стереоселективность цис-восстановления алкинов обусловлена присоединением двух водородов с одной и той же стороны алкина, находящегося на поверхности катализатора.
СВОЙСТВА АЛКЕНОВ Физические свойства Агрегатное состояние алкенов с числом атомов углерода в молекуле от 2 до 4 – газы; от 5 до 17 – жидкости; от 18 и больше – твердые тела. Температуры кипения алкенов подчиняются тем же закономерностям, что и соответствующие алканы. В гомологическом ряду, начиная с С5, Ткип. возрастает на 20-300С с прибавлением группы СН2. Углеводороды нормального строения кипят при более высокой температуре, чем их изомеры. Перемещение двойной связи в центр молекулы повышает температуру кипения. Цис-изомеры кипят при более высокой температуре, чем транс-изомеры. Температура плавления в гомологическом ряду повышается. Транс-изомеры алкенов плавятся при меньших температурах, чем цис- изомеры. Плотность алкенов 0,6-0,8 г/см3. Растворимость в воде мала, но алкены хорошо растворяются в растворах некоторых солей тяжелых металлов, образуя комплексные соли. Они растворимы в неполярных растворителях: бензоле, хлороформе. Алкены не имеют запаха. Только у этилена сладковатый запах. Соединения бесцветны, малотоксичны.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|