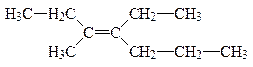|
|
СПОСОБЫ ПОЛУЧЕНИЯ АЛКЕНОВСТРОЕНИЕ, НОМЕНКЛАТУРА, ИЗОМЕРИЯ АЛКЕНОВ
Алкены – ненасыщенные углеводороды с открытой цепью, содержащие в молекуле одну двойную связь. Простейшим представителем алкенов является этилен С2 Н4, в связи с чем соединения этого ряда называют этиленовыми углеводородами. Для них применяется также название олефины, которое происходит от латинского названия gas olefiant – маслородный газ. Это название было дано этилену в XVII веке голландскими химиками из-за его способности образовывать с хлором жидкое маслянистое вещество – дихлорэтан С2 Н4Сl2. Атомы углерода, образующие в алкенах двойную связь, находятся в sp2-гибридизации. Двойная связь состоит из одной σ –связи и одной π – связи.
1.1. sp2 – Гибридное состояние атома углерода и π – связь sp2–Гибридное состояние четырехвалентного атома углерода в алкенах возникает при взаимодействии одной 2s–орбитали и двух 2p–орбиталей. В результате образуются три гибридные sp2–орбитали, расположенные в плоскости под углом в 120°; и остается негибридизованной одна р–орбиталь, которая располагается перпендикулярно к остальным:
sp2–Гибридные орбитали образуют при перекрывании с электронными орбиталями соседних атомов σ-связи. При боковом перекрывании р–орбиталей двух соседних атомов углерода образуется дополнительная связь, получившая название p - связи:
Молекула этилена
Электронная плотность p - связи сосредоточена над и под плоскостью, в которой расположены атомы молекулы. Свойства p - связи: 1) p-связь является значительно менее прочной связью, чем σ – связь; энергия С=С – связи в этилене равна 607 кДж/моль; длина связи 0,134 нм; 2) направленность – перпендикулярная плоскости σ- связей, p - связь пространственно более доступна, чем σ - связь, так как максимум электронной плотности находится над и под плоскостью молекулы; 3) p-связь менее стабильна, чем σ - связь; она значительно легче поляризуется под воздействием внешних факторов или заместителей, смещение электронной плотности по p-связи называется мезомерным эффектом; 4) двойная связь более жесткая, вращение вокруг π-связи затруднено, это является причиной образования у алкенов геометрических изомеров.
Гомологический ряд алкенов
Подобно тому, как от метана производится гомологический ряд алканов, так и от этилена производится гомологический ряд этиленовых углеводородов или алкенов. Каждый последующий член этого ряда отличается от предыдущего на гомологическую разность (СН2). Этиленовые углеводороды имеют общую формулу СnН2n: СН2=СН2 этилен (С2Н4) СН3-СН=СН2 пропилен (С3Н6) СН3-СН2-СН=СН2 бутилен-1 (С4Н8)
Номенклатура алкенов 1. Тривиальные названия алкенов образуются из названия радикалов соответствующих алканов с добавлением окончания ЕН.
2. По рациональной номенклатуре этиленовые углеводороды представляют как производные этилена, у которого атомы водорода замещены на радикалы. Чтобы указать положение радикалов, углеродные атомы этилена обозначают буквами a и b или используют приставки сим. (симметрично) и несим. (несимметрично).
3. По систематической номенклатуре названия этиленовых углеводородов составляют из названий соответствующих предельных углеводородов путем замены окончания АН на ЕН, цифрой в конце названия или перед названием углеводорода указывают положение двойной связи (атома углерода, за которым следует двойная связь).За главную цепь принимается самая длинная цепь с двойной связью. Нумерация углеродных атомов начинают с того конца, к которому ближе двойная связь.
Одновалентные радикалы алкенов имеют тривиальные названия. По систематической номенклатуре их названия складываются из названий соответствующих алкенов и окончания ИЛ. Цифрой указывается положение двойной связи. Часто используются тривиальные названия.
Изомерия алкенов Для алкенов характерны три типа изомерии: 1) углеродного скелета (структурная изомерия); 2) изомерия положения двойной связи в цепи (структурная изомерия); 3) пространственная (геометрическая) цис-транс-изомерия. Структурные изомеры появляются у алкена, имеющего четыре атома углерода: СН3-СН2-СН=СН2 бутен-1
СН3-СН=СН-СН3 бутен-2
По сравнению с алканами число структурных изомеров у алкенов больше, что объясняется изомерией, связанной с положением двойной связи:
Цис-транс-изомерия определяется пространственным расположением заместителей относительно двойной связи, тогда как порядок углеродных атомов скелета и положение двойной связи остается неизменным. Если заместители расположены по одну сторону плоскости, проходящей через двойную связь, говорят, что они находятся в цис-положении (лат. cis - “по эту сторону”) относительно друг друга; если по разные стороны – то это транс-положение (лат. trans “по ту сторону”).
Цис- Транс-
Возможность существования этих изомеров обусловлена тем, что p-связь более жесткая, чем s- и не допускает свободного вращения. Переход одного изомера в другой в обычных условиях невозможен и может быть осуществлен при действии факторов, ослабляющих p–связь (освещение, высокие температуры, катализаторы).
Цис- и транс- изомеры – это стереоизомеры. Эти изомеры устойчивы, их можно выделить, они отличаются как по физическим, так и по химическим свойствам. Транс-изомеры более устойчивые, чем цис-изомеры, т.к. в последних можно обнаружить некоторое перекрывание метильных групп, а в случае групп большего размера даже возникают силы отталкивания. В транс-изомерах группы значительно удалены друг от друга, что практически исключает взаимное влияние. Для перехода от одной формы в другую нужно затратить энергию 257 кДж/моль, т.е. энергию p-связи. С цис-транс-изомерией приходится встречаться очень часто. Условно конфигурацией алкенов считают соответствующую конфигурацию наиболее длинной цепи, включающей двойную связь.
3-метил-4-этил-транс-гептен-3
Это транс-изомер, несмотря на то, что две идентичные группы располагаются в цис-положении относительно друг друга, т.к. алкильные остатки при двойной связи занимают транс-положение по отношению к наиболее длиной цепи, включающей двойную связь. Для изомеров сложного строения используют Е, Z- номенклатуру, которая имеет следующие правила: 1. Используя систему Кана-Ингольда-Прелога, определяют сначала относительное старшинство заместителей, связанных с двойной связью и дают им номера по старшинству 1 или 2. 2. Если две наиболее старшие группы расположены по одну сторону от плоскости p-связи, то конфигурация заместителей обозначается символом Z (zusammen- вместе), если же эти группы находятся по разные стороны от плоскости p-связи, то конфигурацию обозначают символом Е (entgegen– против).
Z E
СПОСОБЫ ПОЛУЧЕНИЯ АЛКЕНОВ Алкены встречаются в природе редко. Низшие алкены в небольших количествах могут входить в состав нефтяного газа, высшие - в состав некоторых нефтей. Важнейшим промышленным поставщиком олефинов является нефтеперерабатывающая промышленность.
Крекинг нефти Это главный промышленный путь получения олефинов, нефть представляет собой смесь углеводородов состава С1-С40, различного строения. Крекинг нефти идет при высокой температуре с образованием алканов, алкенов и Н2. В частности, в процессе крекинга осуществляется реакция дегидрирования, т.е. отщепления двух атома водорода от соседних атомов углерода, с образованием алкенов.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|


 -изобутил
-изобутил
 - изобутилен
- изобутилен
 СН2=С-СН3
СН2=С-СН3