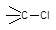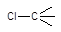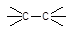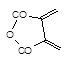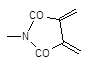|
|
Определение процессов полимеризации и поликонденсацииСуществуют различные варианты формирования цепи макромолекул из низкомолекулярных реагентов. Число таких вариантов можно определить, пользуясь принципами комбинаторики. Так, к молекуле мономера можно присоединить еще одну молекулу мономера, затем к образовавшемуся димеру вновь присоединить одну молекулу мономера и т. д. Такой вариант составления макромолекулы из мономеров показан на рис. 3 ломаной линией 1. Возможны и другие варианты получения макромолекулы, например, образовавшиеся димеры и другие n-меры могут взаимодействовать друг с другом и с мономером (линии 3 и 4). Предельному случаю этого пути процесса соответствует линия 2, отвечающая такой ситуации, при которой димеры взаимодействуют с димерами, тетрамеры с тетрамерами, получившиеся далее октамеры взаимодействуют с октамерами и т. д., т. е. при каждом взаимодействии происходит удвоение длины молекулы реакционноспособного n-мера (дубликация). Из множества вариантов образования макромолекулы из мономеров можно выделить две[i] основные разновидности: полимеризацию и поликонденсацию. Полимеризацией называется процесс образования макромолекул путем последовательного присоединения молекул мономера к реакционным реагентов системы. Общую схему полимеризации можно записать в виде: [–M–]n + M Этой схеме отвечает ломаная линия 1 на рис. 3. Можно сказать, что цепь макромолекулы при полимеризации образуется позвенно, постепенно, как бы наращиванием, поэтому реакцию образования макромолекул при полимеризации называют реакцией роста.
Рис. 3 а) Зависимость степени полимеризация или поликонденсации от числа единичных последовательных реакций образования макромолекулы на начальной стадии процесса; б) Зависимость степени полимеризацияили поликонденсации отчисла последовательных реакций стадии образованна макромолекулы: 1 – полимеризация; 2–поликонденсация удвоением (дубликацией); 3–другие случаи поликонденсации; 4 – поликонденсация, близкая к полимеризации. Поликонденсацией называется процесс образования макромолекул путем взаимодействия друг с другом реакционных центров всех реагентов системы. Схему поликонденсационной сборки макромолекул можно записать в виде: [–M–]n1+ [–M–]n2 Эта схема учитывает также и начало процесса с участием мономеров: М + М Однако, как будет показано ниже, при получении высокомолекулярных продуктов поликонденсацией основную долю взаимодействий составляют реакции олигомеров (n > 1) между собой. Поликонденсации отвечают ломаные кривые 2, 3, 4 на рис. 3. Можно сказать, что цепь макромолекулы в этом случае собирается блоками. Для такого процесса не подходит термин «рост»; для него можно предложить термин «сборка» цепей. Приведенные выше определения достаточно общи, они могут быть отнесены ко всем процессам синтеза полимеров. При этом не требуется введения каких - либо дополнительных терминов (полиприсоединение, миграционная полимеризация и т. д.). Данные определения процессов синтеза полимеров не связаны с химическим строением мономеров и реакционных центров, так как синтез полимеров (поликонденсацией или полимеризацией) можно осуществить различными химическими путями. Кроме того, в определениях ничего не сказано о выделении низкомолекулярных побочных продуктов, поскольку как полимеризация, так и поликонденсация могут протекать с выделением и без выделения низкомолекулярного продукта. При образовании высокомолекулярных соединений (n–велико) ломаные линии на рис. 3а переходят в плавные и процессы образования макромолекул методами полимеризации и поликонденсации изображаются иначе (рис. 3б). Это следует учитывать при построении схем стадийности процессов синтеза полимеров (рис. 1). Так, для полимеризации, не осложненной побочными процессами линия АВ будет прямой, а для поликонденсации - кривой, аналогичной кривой 2 на рис. 3а. Кроме различий, проявляющихся при образовании единичной макромолекулы, процессы полимеризации и поликонденсации различаются и по характеру изменений, происходящих во всей реакционной системе. Изменения в реакционной системе в ходе процесса синтеза полимера (особенно на ранних стадиях) удобно изобразить тройной диаграммой (треугольником Гиббса, рис. 4). Эти диаграммы широко используются при физико-химическом анализе состояния тройных систем (плавкости, растворимости). Такие диаграммы состава тройной системы (системы из трех компонентов) можно применять к закрытым системам, т. е. системам с постоянным числом частиц. Их можно также применить и к взаимно превращающимся химическим системам, в которых соблюдается материальный баланс между реагентами. В процессе синтеза полимеров участвует реакционные центры мономера М и концевые реакционные центры олигомеров и n-меров К (рис. 4). При их взаимодействии образуется полимерная межзвенная связь Р. Каждая точка внутри треугольника обозначает состав системы в определенный момент времени; соединив эти точки, можно получить кривую, характеризующую изменение соотношения между компонентами системы (М, К, Р) в ходе процесса синтеза полимеров. На рис. 4 представлены такие зависимости для различных процессов синтеза полимеров. Прямая NL характеризует процесс образования полимера (увеличение количества образовавшихся связей Р) за счет уменьшения содержания мономера в системе при постоянном содержании концевых групп (т. е. при постоянном содержании растущих полимерных цепей). Следовательно, прямые, параллельные основанию треугольника МР, соответствуют процессу полимеризации. Сама линия МР отвечает предельному случаю полимеризации – полимеризации с участием очень малого числа концевых групп, например рост одной макромолекулы в системе. Путь N'QL отражает процесс поликонденсации, причем на диаграмме ясно видны две его стадии: образование димеров из мономеров (прямая N'Q) и увеличение числа связей за счет уменьшения количества концевых групп олигомеров (отрезок QL). Этот путь отвечает идеализированному процессу. В реальных случаях поликонденсации мономер не исчерпывается полностью после образования димеров, поэтому точка Q в реальных процессах перемещается в точку Q' и, следовательно, реальный процесс поликонденсации описывается NQ'L.
Рис. 4 а) Тройная диаграмма, изображающая протекание процессов синтеза полимеров: MQP–поликонденсация; МР– полимеризация (идеальные процессы); МQ'L – поликонденсация; NL–полимеризация (реальные процессы).; Тройные диаграммы более сложных процессов приведены на рис. 4б. Из рисунка видно, что в начале процесса (отрезок МА) образуются низкомолекулярные продукты с концевыми группами (это соответствует, например, инициированию полимеризации). Далее протекает полимеризация мономера с участием этих концевых центров (отрезок АВ) и наконец процесс заканчивается поликонденсацией (отрезки ВС и СР).
Таким образом, можно сформулировать основные особенности процессов полимеризации и поликонденсации (таблица 1). Следует обратить особое внимание на характер участия молекул мономера в образовании макромолекул полимера. Молекулы мономера участвуют в реакциях образования макромолекул в обоих процессах, но имеются существенные различия в их протекании, обусловленные особенностями последних. При полимеризации мономер является основным реагентом процесса на всем его протяжении; при этом молекулы мономера реагируют с концом растущей цепи в строгой последовательности–одна за одной. По сравнению с этими реакциями вероятность образования макромолекулы за счет взаимодействия олигомеров и n-меров считается близкой к нулю. При поликонденсации молекулы мономера участвуют в реакциях составления цепи макромолекулы с той же вероятностью, что и молекулы других реагентов (олигомеров, n-меров). Поэтому при поликонденсации после присоединения молекулы мономера, например, к тримеру могут последовать реакции взаимодействия образовавшегося тетрамера с n1, n2, n3-мерами, и только после этого может вновь произойти взаимодействие образовавшегося олигомера с мономером. При поликонденсации мономер исчезает из реакционной системы практически на ранних стадиях (на стадиях образования олигомеров), и поэтому основными реагентами в этих процессах (особенно на глубоких стадиях) становятся реакционноспособные олигомеры, взаимодействующие за счет концевых реакционных центров. Таблица 1 Основные особенности простейших процессов полимеризации и поликонденсации
Не следует забывать, что приведенные в таблице 1 и отмеченные на рис. 3 особенности процессов поликонденсации и полимеризации относятся к простейшим (не осложненным процессам). При синтезе полимеров в реальных условиях могут наблюдаться отклонения от этих идеализированных схем. Так, кривая 4 рис. 3б соответствует процессу поликонденсации, очень похожему на полимеризацию. Возможно протекание и таких сложных процессов, при которых олигомеры образуются путем полимеризации, а далее они взаимодействуют между собой по поликонденсационному механизму (рис. 4б). Примером такого процесса является получение поли-e-капроамида, когда сам лактам полимеризуется по схеме:
а образующиеся концевые NH2- и СООН– группы подвергаются поликонденсации:
Выше отмечались особенности лишь стадии образования макромолекулы при различных процессах синтеза полимеров. Однако эти особенности накладывают отпечаток и на некоторые другие стадии. В таблице 2 перечислены реакции, составляющие различные стадии процессов синтеза полимеров. Таблица 2 Основные реакции процессов синтеза полимеров
Глава 2 МОНОМЕРЫ И ОЛИГОМЕРЫ Строение исходных низкомолекулярных веществ–мономеров и их реакционная способность играют большую роль в процессах синтеза полимеров Ими определяется начальная стадия всех процессов синтеза полимеров, от них в значительной степени зависит реакционная способность других реагентов реакционной системы (олигомеров, активных полимерных цепей) и, следовательно, закономерности процессов на глубоких степенях превращения. Для образования полимерной цепи из молекул мономера необходимо, чтобы каждая молекула мономера прореагировала в двух местах, двумя реакционными центрами: nH2N–R–COOH Монофункциональные соединения, реагируя между собой, образуют лишь низкомолекулярные соединения, например:
Me3SiOH + Me3SiOH Реакционным центром называется активная часть (чаще всего один из атомов) молекулы, непосредственно участвующая в химическом взаимодействии. Результатом взаимодействия реакционных центров является образование полимерной межзвенной связи. В ряде случаев межзвенная связь может быть достаточно сложной. Как правило, реакционный центр входит в состав функциональных групп. Функциональной группой называется часть молекулы мономера, определяющая его принадлежность к тому или иному классу соединений и имеющая характерную реакционную способность. Функциональная группа определяет поведение мономера в химических реакциях. Так, в функциональных группах -NH2, -ОН, -N=C=0 реакционными центрами являются в группе –NH2 атом водорода, в группе –ОН атом водорода, в группе –N=C=0 атом азота. Однако в различных условиях и в разных реакциях (в том числе при поликонденсации) одна и та же функциональная группа может иметь разные реакционные центры. Так, при реакции нейтрализации реакционным центром в группе –СООН является атом водорода, а в реакции этерификации реакционным центром в этой же группе становится атом кислорода, соединенный с водородом. В простейших случаях понятие функциональной группы может практически совпадать с понятием реакционного центра (например, атом водорода в –C–H фрагменте). Когда неизвестен механизм реакций и, следовательно, строение реакционного центра, тогда вместо термина «реакционный центр» используется термин «функциональная группа». Некоторые функциональные группы, входящие в состав мономеров, наиболее широко применяемых в промышленной и лабораторной практике поликонденсационного синтеза, приведены в таблице 3. Наиболее широко в практике поликонденсационного синтеза применяются мономеры с группами –ОН, –NH2, –СООН Следует обратить внимание на функциональные группы, при взаимодействии которых с другими группами не происходит образования «побочного» низкомолекулярного продукта К таким группам относятся изоцианатная группа –N=C=0 и винильная группа –СН=СН2. Обычно мономеры с винильной группой (виниловые мономеры) применяются в полимеризационном синтезе, но она может выступать и как функциональная группа поликонденсационного мономера (например, при взаимодействии с дитиолами). Кроме виниловых мономеров в процессах поликонденсации могут использоваться и другие «полимеризационные» мономеры, например, мономеры с аллильной группой, некоторые циклы. Использование при поликонденсации мономеров со сложным строением функциональных групп приводит, как правило, к выделению сложного низкомолекулярного «побочного» продукта реакции или к образованию сложной межзвенной связи. Примерами таких групп могут служить две расположенные рядом простые функциональные группы (например, в орто-положении друг другу). Во многих случаях две такие группы реагируют как одна, давая межзвенную связь сложного строения (таблица 3). Пространственная близость функциональных групп в бифункциональных соединениях приводит, как правило, к изменению их реакционной способности Так, дихлорангидрид орто-фталевой кислоты может находиться в двух формах:
Близкое расположение функциональных групп во втором случае не позволяет использовать такие мономеры для синтеза обычных линейных полимеров, так как при этом создаются значительные стерические препятствия, снижающие реакционную способность мономера. Было найдено также, например, что добавки о-фенилендиамина при поликонденсации м-фенилендиамина с дихлорангидридом изофталевой кислоты существенно снижают молекулярную массу образующегося сополимера. Функциональные группы, вступающие в процессы поликонденсации, могут содержать в своем составе атомы различных элементов. Так, в таблице 3 приведен пример мономера с функциональными группами (связями) ионного и координационного типа, который может быть использован для проведения процесса поликонденсации (в данном случае координационной поликонденсации). Таблица 3 Некоторые функциональные группы, входящие в состав
В таблице 3 не приведены мономеры с такой широко распространенной функциональной группой, как нитрогруппа. Это объясняется тем, что группа NO2, соединенная с органическим радикалом, не имеет функциональности, т е. не способна вступать в какие-либо реакции Однако в последнее время найден способ использования мономеров с группой NO2 в реакциях поликонденсации путем превращения ее в аминогруппу непосредственно в самом поликонденсационном процессе. МОНОМЕРЫ 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 [–M–]n+1
[–M–]n+1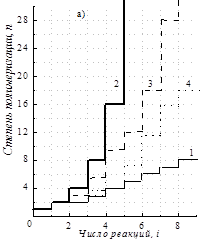

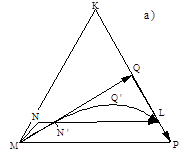


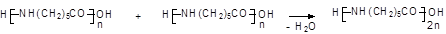
 Более глубоко стадии процессов поликонденсации рассматриваются в лекционном курсе. Далее будут рассмотрены вопросы реакционной способности и синтеза мономеров для поликонденсации.
Более глубоко стадии процессов поликонденсации рассматриваются в лекционном курсе. Далее будут рассмотрены вопросы реакционной способности и синтеза мономеров для поликонденсации. [–NHRCO–]n+ Н2О
[–NHRCO–]n+ Н2О