
|
|
Тема: АГРЕГАТНЫЕ И ФАЗОВЫЕ СОСТОЯНИЯ ВЕЩЕСТВА. ФАЗОВЫЕ ПЕРЕХОДЫМОЛЕКУЛЯРНАЯ ФИЗИКА
Санкт-Петербург 2014
Печатается по постановлению Ученого совета Физического факультета СПбГУ от 17 июня 2014. Ответственный редактор: Е.П. Зароченцева.
Составители:И.С. Бобкова, Б.Д. Катунин, Д.А. Лисаченко, А.В. Бармасов, Н.А. Малешина.
Рецензенты: профессор И.Ч. Машек, доцент Т.Н. Компаниец
Описания лабораторных работ Учебной лаборатории физического эксперимента Физического факультета СПбГУ. Часть 2: Молекулярная физика / И.С. Бобкова и др.; Под ред. Е.П. Зароченцевой; СПб, 2014. –53 с.
Данное пособие содержит описания лабораторных работ по разделу «Молекулярная физика» курса общей физики и представляет собой существенно переработанное и дополненное переиздание учебного пособия «Механика и молекулярная физика, ч. 11. / Под ред. В.Е. Холмогорова» (Л.: Изд-во ЛГУ, 1990. – 52 с.). Каждая лабораторная работа рассчитана на 4 академических часа. Студент допускается к выполнению лабораторной работы после самостоятельного изучения необходимой теории, ознакомления с порядком выполнения основных операций и сдачи зачёта по технике безопасности. Предназначено для студентов факультетов: Биолого-почвенного, Географии и геоэкологии, Геологического, Медицинского, Химического и др. ã Е.П. Зароченцева, И.С. Бобкова и др., Ó Санкт-Петербургский государственный университет, 2014.
СОДЕРЖАНИЕ
Тема: ТЕПЛОЁМКОСТЬ ИДЕАЛЬНОГО ГАЗА Введение. Для характеристики макроскопических тепловых свойств систем пользуются особым параметром – теплоемкостью системы. Теплоемкость C термодинамической системы равна количеству теплоты Q, которое необходимо передать системе (или отвести от нее), чтобы изменить ее температуру T на 1 К (или 1 °С); При передаче термодинамической системе бесконечно малого количества теплоты dQ его температура изменится на бесконечно малую величину dT, тогда:
Удельной теплоемкостью вещества c называется величина, равная количеству теплоты, которую необходимо сообщить единице массы вещества для увеличения ее температуры на 1 К:
где m – масса. Для газовудобно пользоваться молярной теплоемкостью Cm – количеством теплоты, необходимым для нагревания одного моля данного вещества на 1 К:
где µ – молярная масса вещества; Теплоемкость газов зависит от строения молекулы данного газа – числа атомов в молекуле и их взаимного расположения, т. е. от количества степеней свободы данной молекулы. Кроме того, теплоемкость зависит от типа термодинамического процесса. Число степеней свободы i в механике – это число независимых координат, определяющих положение механической системы в пространстве, причем таких, по которым элементы системы могут двигаться. Например, поршень в цилиндре может двигаться только по оси цилиндра, поэтому у него одна степень свободы. В соответствии с характером этого движения различают поступательные, вращательные и колебательные степени свободы. При определении числа степеней свободыдлямолекулыее можно рассматривать как систему материальных точек – атомов. Колебательные степени свободы существуют у молекул с упругой связью между атомами. Однако при температурах вблизи комнатной колебательные степени свободы не вносят вклад в теплоемкость многоатомного газа, они выключены («заморожены»), так как могут возбуждаться лишь при достаточно высоких температурах. Колебательное движение характеризуется наличием и потенциальной и кинетической энергий, средние значения которых равны, тогда на каждую колебательную степень свободы в среднем приходится энергия в 2 раза больше. Общее число степеней свободы
Одноатомная молекула способна совершать толькопоступательное движение соответствующее перемещениям вдоль осей X, Y и Z, для неё i = 3 (три степени свободы).
Для трехатомной молекулы i = 6 (три поступательных и три вращательных степени свободы). В классической статистической физике показано (закон равнораспределения энергии по степеням свободы), что на каждую степень свободы приходится в среднем энергия Таким образом, средняя энергия E молекулы равна:
где i – сумма возможных степеней свободы молекулы, k – постоянная Больцмана, T – температура. В соответствии с первым началом термодинамики количество теплоты dQ, подводимое к газу, может расходоваться на увеличение внутренней энергии газа dU и на совершение работы dA при расширении газа:
Увеличение внутренней энергии одного моля идеального газа в случае изменения его температуры на dT рассчитывается по формуле:
где R – универсальная газовая постоянная (R≈8,3∙103 Дж·кмоль–1·К–1). При расширении газа система выполняет работу dA:
Величина теплоемкости существенно зависит от того, при каких условиях нагревался газ. 1. Изохорический процесс, протекающий при постоянном объеме системы (V = const). В этом случае работа по расширению газа отсутствует (ΔV = 0, поэтому A = pΔV = 0) и dQ = dU, следовательно, молярная теплоемкость газа при постоянном объеме CV:
2. Изобарический процесс, протекающий при постоянном давлении системы (p = const). В этом случае работа не равна нулю.
где Cp – молярная теплоемкость газа при постоянном давлении. Итак, при нагревании при постоянном давлении часть теплоты идет на производство работы расширения тела, а часть – на увеличение его внутренней энергии, тогда как при нагревании при постоянном объеме вся теплота расходуется на увеличение внутренней энергии, и поэтому Cp всегда больше, чем CV. Используя уравнение состояния идеального газа (уравнение Менделеева–Клапейрона) для одного моля газа:
можно показать, что:
Поэтому уравнение (11) можно переписать в виде формулы Мáйера:
Тогда, разделив Cp на CV, получим:
Величина γ имеет самостоятельный смысл в термодинамике, она входит в уравнение, описывающие адиабатический процесс, –уравнение Пуассóна– и называется показателем адиабаты или коэффициентом Пуассóна. Адиабатический процесс– это процесс, протекающий без теплообмена системы с окружающей средой (dQ = 0). На практике адиабатическими процессами являются процессы, протекающие очень быстро, и теплообмен с окружающей средой просто не успевает произойти, или же процессы, протекающие в системах, находящихся в термостате (например, в термосе). Уравнение адиабаты:
Это уравнение Пуассона. С учетом уравнения Менделеева–Клапейрона – уравнение можно переписать, используя другие параметры состояния идеального газа (всюду ν = const):
Как видно из (15), γ для любого идеального газа зависит только от числа степеней свободы его молекул. Табл. 1. Число степеней свободы для некоторых молекул
Впервые измерение отношения теплоёмкостей для газов было осуществлено французскими химиками Н. Клемáном и Ш. Дезóрмом в 1819 г., метод основывается на изучении параметров некоторой массы газа, переходящей из одного состояния в другое двумя последовательными процессами – адиабатическим и изохорическим.
Лабораторная работа 9 ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЁМКОСТЕЙ ГАЗОВ МЕТОДОМ АДИАБАТИЧЕСКОГО РАСШИРЕНИЯ (МЕТОДОМ КЛЕМАНА И ДЕЗОРМА) Цели и задачи работы 1. Изучение термодинамических процессов в воздухе. 2. Определение показателя адиабаты γ для воздуха адиабатическим методом Клемана и Дезорма. Физическое обоснование эксперимента Выделим мысленно в сосуде некоторую порцию газа (ν молей), и в дальнейшем будем следить за изменениями происходящие только с этой порцией. Рассмотрим процессы, представленные р–V-диаграммой (рис. 9.1). Исходное состояние 1 характеризуется параметрами p1, V1 и T1, где p1 – атмосферное давление, T1 – комнатная температура. Накачаем в сосуд воздух (процесс 1–2). При этом газ в сосуде сожмётся и нагреется (состояние 2). После отключения сосуда от насоса (перекрывания крана) газ будет остывать до комнатной температуры при постоянном объеме (изохорический процесс 2–3). Для состояния 3 обозначим соответственно объем V3 (V3 = V2), и температуру Т3 (Т3 = Т1). в состоянии 3 давление p3 установится больше атмосферного на Δp3. Последняя величина определяется по разности уровней подкрашенной жидкости h1 в коленах манометра М. Если теперь на короткое время соединить баллон с атмосферой, то произойдёт быстрое, а, следовательно, адиабатическое расширение воздуха (процесс 3–4). При этом давление понизится до атмосферного p4 = p1. Рассматриваемая масса воздуха займет объём V4. При этом температура воздуха понизится до Т4 < T1.
Поскольку процесс 3–4 – адиабатический, к нему можно применить уравнение Пуассона:
После адиабатического расширения воздух в баллоне будет нагреваться (процесс 4–5) до температуры окружающей среды Т5 = Т1 при постоянном объёме V5 = V4. При этом давление в баллоне поднимется до (p5 = p1 + Δp5). Изменение давления Δp5 можно определить по разности уровней подкрашенной жидкости h2 в коленах манометра М. Поскольку процесс 4–5 – изохорический, к нему можно применить закон Шарля:
Сопоставив уравнения 9.3 и 9.4, получим:
Прологарифмируем:
Поскольку избыточные давления Δp3 и Δp5 малы по сравнению с атмосферным давлением p1 и, учитывая, что для натуральных логарифмов ln(1 + x) ≈ x при x << 1, будем иметь:
откуда
Описание экспериментальных установок.
Экспериментальная установка представляет собой большой стеклянный толстостенный сосуд А, соединённый с жидкостным U-образным манометром М, по которому измеряют разность h между давлением p внутри сосуда А и атмосферным давлением p1. Внутрь сосуда А помещён один из двух спаев термопары С, концы которой выведены к милливольтметру В. Второй спай термопары находится вне сосуда. Таким образом, милливольтметр фактически показывает изменение температуры воздуха внутри сосуда по сравнению с комнатной температурой. Установка оборудована ручным стеклянным трёхходовым распределительным краном (см. на вставке рис.9.2). Трёхходовой кран К позволяет соединять сосуд А либо с атмосферой (положение I крана), либо с насосом (положение II крана), либо изолировать систему и от атмосферы, и от насоса (положение III крана). Отверстие в пробке крана находится со стороны ручки. Для осушения воздуха в сосуде и, таким образом, исключения необходимости учёта наличия в воздухе паров воды (т. е. трёхатомных молекул) на дне сосуда А помещён влагопоглощающий порошок. Две установки могут работать независимо друг от друга, однако они оснащены одним воздушным насосом, что исключает возможность одновременного повышения давления в обоих сосудах. Вариант 2. Для определения отношения теплоёмкостей воздуха также предназначена экспериментальная установка ФПТ 1-6. (рис.9.3). Данная установка состоит из стеклянной колбы, соединенной с открытым водяным манометром 2.
Порядок выполнения работы на установке со стеклянным трёхходовым краном 1. Включить осветитель милливольтметра В и записать положение светового указателя при комнатной температуре. 2. Повернуть стеклянный трёхходовой кран так, чтобы объём сосуда был соединён с резиновой трубкой, идущей к насосу. Вращая пробку крана одной рукой, другой рукой необходимо придерживать сам кран, во избежание его поломки. 3. Соединить трубку установки с выпускным патрубком воздушного насоса. 4. Включить насос. Довести давление до выбранного (следя по манометру М). 5. повернуть кран так, чтобы объём сосуда был изолирован и от атмосферы, и от резиновой трубки, идущей к насосу, и выключить насос. 6. После возвращения указателя милливольтметра в исходное положение(когда температура T3 внутри сосуда сравнялась с комнатной температурой) отсчитать разность уровней h1 манометра М. 7. На короткое время повернуть кран так, чтобы объём сосуда был соединён с атмосферой. Как только давление сравняется с атмосферным, перекрыть кран. 8. После возвращения указателя милливольтметра В в исходное положение (T5 = T1) измерить разность уровней h2 в манометре М. 9. Провести эксперимент не менее 10 раз и результаты измерений занести в таблицу 9.1. Порядок выполнения работы на экспериментальной установке ФПТ 1-6 1. Включить установку тумблером «Сеть». 2. Установить пневмотумблер «Атмосфера» в положение «Закрыто». Для подачи воздуха в колбу включите тумблер «Воздух». 3. С помощью манометра контролируйте давление в колбе. Когда разность уровней воды в манометре достигнет 150–250 мм вод. ст., отключить подачу воздуха. 4. Подождать 2–3 мин., пока температура воздуха в колбе сравняется с температурой окружающего воздуха Т1. В колбе при этом установится постоянное давление p3 ( 5. На короткое время соединить колбу с атмосферой, установив пневмотумблер «Атмосфера» в положение «Открыто». 6. Через 2–3 мин., когда в колбе установится постоянное давление p5, определить разность уровней h2, установившуюся в коленах манометра, и записать его в таблицу. 7. Повторить измерения не менее 10 раз при различных значениях величины h1 и результаты измерений занести в таблицу 9.1. Таблица 9.1. Результаты измерений
Обработка результатов измерений 1. Для каждого измеренного значения h1 и h2 вычислить значение отношения теплоёмкостей γ. 2. рассчитать среднее значение γ, и доверительные границы погрешности Δγ по алгоритму прямых измерений. Содержание отчёта 1. Значения измерений h1 и h2 для всех опытов. 2. Вычисленные значения γ для всех опытов. 3. Среднее значение величины γ и доверительные границы Δγ. Контрольные вопросы s Какой процесс называется адиабатическим и как он осуществляется в данной работе? s Почему теплоёмкость при постоянном давлении отличается от теплоёмкости при постоянном объеме. s Чему равно число степеней свободы для одно-, двух- и многоатомных молекул? s Почему в данном эксперименте целесообразно использовать сосуд возможно большего диаметра? s Как повлияет на ход эксперимента наличие паров воды в воздухе?
Лабораторная работа 10 ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЁМКОСТИ ВОЗДУХА ПРИ ПОСТОЯННОМ ДАВЛЕНИИ Cp К ЕГО ТЕПЛОЁМКОСТИ ПРИ ПОСТОЯННОМ ОБЪЁМЕ CV МЕТОДОМ СТОЯЧЕЙ ВОЛНЫ Цели и задачи работы 1. Определение скорости распространения звуковых волн в воздухе при комнатной температуре. 2. Определение постоянной адиабаты для воздуха. Внимательно прочитайте Введение по теме «Теплоемкость идеального газа» Физическое обоснование эксперимента Тип волн, способных распространяться в среде, зависит от упругих свойств среды. Вид распространяющихся в среде колебаний определяется смещением, вызывающим упругую деформацию среды. В среде, обнаруживающей только деформацию растяжения или сжатия(жидкости, газы), распространяются исключительно продольные волны. Примером продольных волн являются звуковые волны в воздухе. Звуковыми или акустическими волнаминазывают упругие волны малой интенсивности, т. е. слабые механические возмущения, распространяющиеся в упругой среде. Звуковые колебания, воздействуя на органы слуха человека, способны вызвать ощущения, если частоты ν соответствующих им колебаний лежат примерно в пределах от 16 Гц до 20 кГц – слышимые звуки. Упругие волны с частотами менее 16 Гц называются инфразвуком, а с частотами более 20 кГц – ультразвуком. Распространение упругих волн в газе (воздухе) определяется объемной упругостью – способностью газа сопротивляться изменению его объема. Это свойство газа проявляется в изменении давления газа при изменении его объема, поэтому для описания упругих волн в газе обычно используется избыточное давление Δр (положительное или отрицательное), равное отклонению переменного давления от равновесного давления p.
Формулу, связывающую скорость звука u в газе с характеристиками состояния газа, можно получить, используя законы механики. Выделим объем газа в форме цилиндра с площадью поперечного сечения S и длиною L. Изменение давления в таком цилиндре обусловлено его сжатием или растяжением, т.е. упругой деформацией, которая подчиняется закону Гука:
В этом выражении F – сила, действующая на основание цилиндра, S – площадь, ΔL/L – относительная линейная деформация, α – коэффициент упругости. Сила обусловлена избыточным давлением F =ΔpS, относительную линейную деформацию можно заменить относительной объемной, так как столб газа сжимается только вдоль длины, не меняя поперечного сечения. Тогда:
Известно, что скорость распространения продольных волн u определяется уравнением
где ρ – плотность газа, α– коэффициент упругости, подставив сюда полученное значение α, получим: .
Опыт показывает, что изменения давления и температуры в звуковой волне происходят настолько быстро, а теплопроводность воздуха настолько мала, что для таких процессов теплообмен не играет существенной роли. Разности температур между областями сжатия и разрежения воздуха в звуковой волне не успевают выровняться, поэтому распространение звука можно считать адиабатическим процессом. В этих условиях можно определить связь изменения Δp давления газа с малым изменением ΔV его объема. Дифференцируя уравнение Пуассона:
где γ – показатель адиабаты, получим:
Откуда:
и для малых изменений давления:
где знак «минус» означает, что увеличение давления соответствует уменьшению объема. Сравнивая формулы (10.1) и (10.5), получим:
Используя уравнение Менделеева–Клапейрона, можно отношение В результате для скорости звука в газе получим формулу Лапласа:
Таким образом, скорость звука пропорциональна квадратному корню из термодинамической температуры и ряду констант, характеризующих тип газа, при этом скорость звука не зависит от давления. Для вычисления показателя адиабаты
Стоячая волна – частный случай интерференции – образуется в результате наложения двух бегущих синусоидальных волн, которые распространяются навстречу друг другу, и имеют одинаковые частоты и амплитуды. Расстояние l, на которое распространяется волна за время, равное периоду колебаний, называется длиной волны. В точках, где волны встречаются в одной фазе, образуются интерференционные максимумы – их называют пучностями стоячей волны, минимумы называют узлами. Как показывает расчет расстояние между пучностями равно половине длины волны(λ/2)
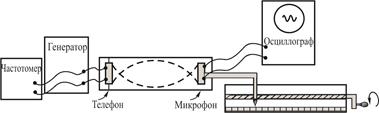
Рис. 10.1. Возникновение стоячей волны. ─ ─ ─ ─ ─ прямая волна, ·─·─·─·─·─ отражённая волна Характерные особенности стоячей волны в отличие от обычной распространяющейся, или бегущей, волны следующие: 1) В стоячей волне амплитуды колебаний различны в различных местах системы; в системе имеются узлы и пучности колебаний. 2) В пределах участка системы от одного узла до соседнего все точки среды колеблются в одинаковой фазе; при переходе к соседнему участку фазы колебания меняются на обратные. 3) В стоячей волне нет направленного переноса энергии, как это имеет место в бегущей волне. Метод исследования и описание установки Установка состоит из пластмассовой трубы, с одного конца которой неподвижно закреплён телефон (динамик), а у противоположного конца помещён микрофон закреплённый на металлическом штоке. Другой конец штока жёстко связан с указателем, который может перемещаться вдоль винта, при вращении последнего с помощью рукоятки. Таким образом, при вращении винта рукояткой указатель перемещается по салазкам и перемещает при помощи штока микрофон вдоль трубы. Положение микрофона внутри трубы может фиксироваться при помощи указателя и шкалы, помещённой под салазками на оправе, крепящей винт.
На телефон подаётся синусоидальное напряжение различной частоты ν от звукового генератора. Частота ν измеряется с помощью частотомера. Сигнал с микрофона подаётся на осциллограф, на экране которого можно увидеть амплитуду сигнала. Труба закрыта с обоих концов, поэтому звук претерпевает в ней многократные отражения, и на осциллографе отображается суммарная амплитуда падающей волны, отраженной двукратно, четырехкратно и т.д. Поскольку волны попадают на микрофон в произвольных фазах, в среднем они взаимно гасят друг друга. когда разность хода (т.е. расстояние S между телефоном и микрофоном туда и обратно) кратна целому числу длин волн, их амплитуды складываются. Таким образом, когда S = kλ (k – целое число) на осциллографе наблюдается максимальный сигнал. Следующий максимум будет наблюдаться при смещении микрофона на λ/2. Порядок выполнения работы 1. Включить электропитание данной лабораторной работы с помощью дежурного сотрудника. Включить звуковой генератор, частотомер и осциллограф и дать им прогреться 5–10 минут. 2. Установить на звуковом генераторе частоту «1500 Гц». 3. Определить значение частоты звуковых колебаний ν по показанию частотомера (оно может незначительно отличаться от установленного в пункте 2). 4. Вращая рукоятку, перемещать винт вместе с микрофоном. Найти ближайшее к одному из концов трубы положение микрофона, при котором сигнал микрофона, наблюдаемый на осциллографе, будет максимальным при данной интенсивности сигнала звукового генератора. Записать показания шкалы напротив рейтера. Для исключения возможного люфта («свободного» хода) штока необходимо отсчёт положения штока всегда производить в одном направлении (при движении либо слева направо, либо справа налево), т.е. вращать рукоятку для снятия отсчёта только в одну сторону. 5. Перемещая микрофон вдоль трубы, зафиксировать все положения микрофона, при которых сигнал на осциллографе будет максимальным. При каждом положении записать отсчёт по шкале. 6. Из полученных для данной частоты положений максимумов, рассчитать длину звуковой волны λ. 7. Вычислить скорость звука по формуле 8. Повторить измерения, указанные в пунктах 4–7, для разных частот генератора (например, для ν = 2000, 2500, 3000, 3500, 4000 Гц), определяя каждый раз длину волны и скорость звуковой волны. 9. Измерить по термометру температуру воздуха в комнате во время эксперимента. 10. По алгоритму прямых измерений по всем определенным значениям скорости звука в воздухе найти среднее значение скорости u и ее погрешность Δu. 11. Рассчитать по формуле (10.8) значение показателя адиабаты γ для воздуха (R ≈ 8,31·103 Дж·кмоль–1·К–1, μ ≈ 29 кг·кмоль–1). 12. Рассчитать погрешность γ по формуле: Содержание отчёта 1. Задача и цель работы, метод исследования, основные схемы, характеристики приборов и т.п. 2. Полученные результаты и расчёты (см. Табл. 1). 3. Среднее значение скорости звука u и доверительные границы его погрешности, вычисленные по алгоритму прямых измерений. 4. Среднее значение γ и доверительную границу Δγ. 5. Окончательные результаты для средних значений скорости звука и показателя адиабаты для воздуха при определённой температуре. Таблица 1. Результаты измерений и вычислений
Контрольные вопросы s Что такое адиабатический процесс? Почему процесс распространения звуковой волны в газе – адиабатический? s Что такое звуковая волна? s Как изменяется скорость звука в воздухе при изменении его температуры? s Почему теплоёмкость при постоянном давлении отличается от теплоёмкости при постоянном объеме. s Чему равно число степеней свободы для одно-, двух- и многоатомных молекул?
Тема: АГРЕГАТНЫЕ И ФАЗОВЫЕ СОСТОЯНИЯ ВЕЩЕСТВА. ФАЗОВЫЕ ПЕРЕХОДЫ Введение Говоря об агрегатных состояниях вещества, имеют в виду такие характеристики, как наличие или отсутствие собственной формы и собственного объема тела, а также способность к их сохранению. Известны три агрегатных состояния вещества: твердое, жидкое и газообразное. Тело в твердом агрегатном состоянии имеет собственный объем и форму и сопротивляется их изменению при внешнем воздействии. Тело в жидком агрегатном состоянии имеет собственный объем, но почти не сопротивляется изменению формы. Сила тяжести легко изменяет собственную форму жидкого тела, поэтому наблюдать собственную форму жидкого тела удается лишь в особых условиях, например, в условиях невесомости, а также у маленьких капель, лежащих на несмачиваемой ими поверхности. В реальных условиях жидкость принимает форму сосуда, в котором находится. Тело в газообразном агрегатном состоянии не имеет ни собственной формы, ни собственного объема: газы занимают весь предоставленный им объем и принимают форму заключающего их сосуда. Различие в агрегатных состояниях связаны с соотношением абсолютных значений энергии межмолекулярного взаимодействия Eмв и энергии теплового движения Eт. Если Eмв намного больше Eт, то тело является твердым. Если Eт >> Eмв – тело является газообразным. Промежуточному соотношению энергий соответствует жидкое состояние. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
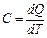 .
.
 ,
,

 → Cm = cμ,
→ Cm = cμ,
 – количество молей вещества; c – удельная теплоемкость. Молярная теплоемкость в системе СИ измеряется в Дж·моль–1·К–1 (в дальнейшем молярную теплоемкость будем обозначать С).
– количество молей вещества; c – удельная теплоемкость. Молярная теплоемкость в системе СИ измеряется в Дж·моль–1·К–1 (в дальнейшем молярную теплоемкость будем обозначать С). .
.
 .
.
 Для двухатомной молекулы (например, N2 или H2) к трем поступательным степеням свободы добавляются две вращательные, соответствующие вращениям вокруг осей X и Z. Вращение вокруг оси Y для такой модели молекулы не приводит ни к каким изменениям. Такая степень свободы называется вырожденной.
Для двухатомной молекулы (например, N2 или H2) к трем поступательным степеням свободы добавляются две вращательные, соответствующие вращениям вокруг осей X и Z. Вращение вокруг оси Y для такой модели молекулы не приводит ни к каким изменениям. Такая степень свободы называется вырожденной. (где k – постоянная Больцмана, T – абсолютная температура).
(где k – постоянная Больцмана, T – абсолютная температура). ,
,
 .
.
 .
.
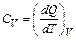
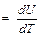



 ,
,
 ,
,
 .
.
 .
.
 .
.





 .
.

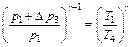 .
.

 .
.
 .
.

 .
.

 ,
,

 .
.
 Вариант 1.
Вариант 1.
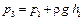 ). Определить разность уровней h1, установившуюся в коленах манометра, и полученное значение занести в таблицу.
). Определить разность уровней h1, установившуюся в коленах манометра, и полученное значение занести в таблицу.



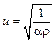 ,
,


 ,
,
 .
.

 ,
,

 ,
,

 .
.
 заменить на
заменить на  , где: R – универсальная газовая постоянная; Т – термодинамическая температура; μ – молярная масса газа.
, где: R – универсальная газовая постоянная; Т – термодинамическая температура; μ – молярная масса газа. 

 .
.
 необходимо определить скорость звукав газе и его температуру:
необходимо определить скорость звукав газе и его температуру: .
.

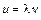 .
. .
.