
|
|
ТЕПЛОЁМКОСТЬ РАБОЧЕГО ТЕЛА
Теплоемкостью называют количество теплоты, которое необходимо сообщить телу (газу), чтобы повысить температуру какой-либо количественной единицы на 1° С. Для определения значений перечисленных выше теплоемкостей достаточно знать величину одной какой-либо - из них. Удобнее, всего иметь величину мольной теплоемкости, тогда массовая теплоемкость:
а объемная теплоемкость: Объемная и массовая теплоемкости связаны между собой зависимостью:
где Теплоемкость газа зависит от его температуры. По этому признаку различают среднюю и истинную теплоёмкость. Если q- количествотеплоты , сообщаемой единице количества газа (или отнимаемого от него) при изменении температуры газа от t1 до t2 то
Представляет собой среднюю теплоёмкость в пределах
ИЗОХОРНЫЙ ПРОЦЕСС ГАЗА
Изохорный процесс – процесс сообщения или отнятия теплоты при постоянном объеме газа (v = const). При постоянном объёме давление газа изменяется прямо пропорционально абсолютным температурам:
Внешняя работа газа при v = const равна нулю l=0. количество теплоты или изменение внутренней энергии газа:
Изохорный процесс на pv – диаграмме отображается прямой вертикальной линией - изохора. При положительном количестве тепла линия идёт снизу вверх.
Изменение энтропии находится:
ИЗОБАРНЫЙ ПРОЦЕСС ГАЗА.
Изобарный процесс – процесс сообщения или отнятия теплоты при постоянном давлении (р = const) Кривая процесса называется изобарой. Поскольку в изобарном процессе dp=0 то в системе не совершается техническая работа , а количество тепла необходимое для перехода тела из состояния 1 в состояние 2 определяется как:
Таким образом в изобарном термодинамическом процессе подводимое (отводимое ) к телу количество тепла пропорционально изменению энтальпии в данном процессе. Данный вывод справедлив как для обратимого так и для необратимого процессов, при условии, что система находится в термодинамическом равновесии в начале и конце процесса. В случае обратимого процесса:
Изобарный процесс на pv – диаграмме отображается прямой горизонтальной линией. При подводе тепла в процесс линия простирается слева направо.
Механическая работа в таком процессе:
Удельная располагаемая (полезная) внешняя работа: Изменение удельной внутренней энергии: Из уравнения состояния идеального газа можно получить следующее соотношение для изобарного процесса:
Таким образом, при изобарном процессе объём идеального газа пропорционален абсолютной температуре. При расширении газа температура повышается, при сжатии уменьшается. Изменение энтропии в изобарном процессе может быть расчитано следующим образом:
ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС ГАЗА. Изотермический процесс – процесс сообщения или. отнятия теплоты при постоянной температуре (t — const) Для изотермического процесса идеального газа зависимость между начальными и конечными параметрами определяется формулами:
При постоянной температуре объём газа изменяется обратно пропорционально его давлению. На pv- диаграмме изотермы идеального газа представляются равносторонней гиперболой. Площадь под кривой процесса численно выражает механическую работу в данном процессе. Работа 1 кг идеального газа находят из уравнений:
Так как в изотермическом процессе t = const, то для идеального газа
Изменение энтропии в изотермическом процессе выразится следующей формулой:
АДИАБАТНЫЙ ПРОЦЕСС ГАЗА. Процесс протекающий без подвода и отвода теплоты, т.е. при отсутствии теплообмена с окружающей средой, называют адиабатным, а кривая этого процесса –адиабатой. Условия процесса: dq=0 , q=0. Т.к. dq=0 , то согласно первому закону термодинамики: и Таким образом совершаемая рабочим телом механическая работа в адиабатном термодинамическом процессе равна уменьшению внутренней энергии тела, техническая работа при этом пропорциональна изменению (уменьшению) энтальпии. В обратимом диабатном процессе энтропия термодинамического тела не меняется: S=Const. Уравнение адиабаты в системе координат pv –диаграммы при постоянной теплоёмкости (
Зависимости между начальными и конечными параметрами процесса: между р и v между T и v между р и T Работу 1 кг газа находят по следующим формулам
Изменение внутренней энергии газа и работа адиабатного процесса равны по величине и противоположны по знаку. . Изменение внутренней энергии идеального газа в адиабатном процессе может быть также выражено уравнением

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|

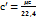

 - плотность газа при нормальных условиях.
- плотность газа при нормальных условиях.
 . Предел этого отношения, когда разность температур стремиться к нулю, называют истинной теплоёмкостью.
. Предел этого отношения, когда разность температур стремиться к нулю, называют истинной теплоёмкостью.
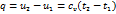




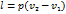

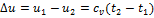
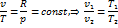



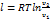
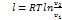






 ) для идеального газа:
) для идеального газа:  где
где  - показатель адиабаты
- показатель адиабаты
 ,
,






