
|
|
ЭНТАЛЬПИЯ. ФИЗИЧЕСКИЕ СВОЙСТВАЭнтальпия Энтальпией термодинамического тела называют сумму внутренней энергии u и произведения pv. i = и + pv. Дифференцируя данное соотношение получим: di = du + pdv + vdp , или du + pdv = di - vdp . На основе первого закона термодинамики dq = du + pdv последнее соотношение перепишется в виде: dq = di - vdp ,или dq = dh + dlt, где dlt - есть дифференциал технической работы (dlt = - vdp). Полученное уравнение является также второй формулировкой первого закона термодинамики, используя понятия энтальпии и технической работы. Величина i может также рассматриваться как параметр состояния термодинамического тела наряду с ранее введенными p, v, T, и. Физический смысл величины i может пояснен на основе уравнения dq = di - vdp, которое для процесса p = const запишется как: dqp = di . (86) Откуда следует, что di есть элементарное количество теплоты, подведенное к термодинамическому телу в процессе постоянного давления.
Изменение энтальпии в любом процессе определяется только начальным и конечным состояниями тела и не зависит от характера процесса. Энтропия является функцией состояния, поэтому её изменение в термодинамическом процессе определяется только начальными и конечными значениями параметров состояния. Изменение энтропии в основных термодинамических процессах: в изохорном в изобарном в изотермическом в адиабатном
в политропном
ВНУТРЕННЯЯ ЭНЕРГИЯ РАБОЧЕГО ТЕЛА, ФИЗИЧЕСКИЙ СМЫСЛ И РАЗМЕРНОСТЬ. Внутренняя энергия – это вся энергия заключенная в теле или системе тел. Эту энергию можно представить в виде суммы отдельных видов энергий: кинетической энергии молекул, включающей энергию поступательного и вращательного движения молекул, а также колебательного движения атомов в самой молекуле; энергии электронов; внутриядерной энергии; энергии взаимодействия между ядром молекулы и электронами; потенциальной энергии или энергии положения молекул в каком либо внешнем поле сил; энергии электромагнитного излучения. Полную внутреннюю энергию тела принято обозначать U (Дж), а удельную внутреннюю энергию u (Дж/кг). Внутренняя энергия равна:
Где В технической термодинамике рассматриваются только такие процессы, в которых изменяются кинетическая и потенциальная составляющие внутренней энергии. Изменение внутренней энергии идеального газа для любого процесса при бесконечно малом изменении состояния (для 1 кг) В теплотехнических расчётах обычно требуется знать изменение внутренней энергии
где Таким образом, изменение внутренней энергии идеального газа для любого процесса равно произведению средней теплоёмкости при постоянном объёме на разность температур газа.
ПРОЦЕССЫ ОБРАТИМЫЕ И НЕОБРАТИМЫЕ. РАВНОВЕСНЫЕ И НЕРАВНОВЕСНЫЕ Термодинамический процесс – это последовательное изменение состояния тела, происходящее в результате энергетического взаимодействия рабочего тела с окружающей средой. Понятия обратимый и необратимый термодинамический процесс тесно связаны с равновесием системы. Рассмотрим такую термодинамическую систему у которой отсутствует теплообмен с окружающей средой (адиабатная термодинамическая система). Происходящие в такой системе термодинамические процессы называют обратимыми, если система в ходе прямого и обратного процесса вернется в исходное состояние без какого-либо дополнительного теплового воздействия окружающей среды на систему. В случае если система в ходе обратного процесса не может возвратиться в исходное состояние или для этого требуется подвод тепла, то такой процесс называется необратимым. Процесс при каждом изменении давления и температуры может быть обратимым только в том случае, когда на протяжении всего процесса от точки к точке термодинамической системы давление постоянно и температура в каждой точке равна температуре окружающей среды или их разность бесконечно мала. обратимые термодинамические процессы являются идеальным или теоретическим случаем. Все реальные процессы являются необратимыми, так как на практике выполнение условия квазистатичности трудно выполнимо. Кроме того, необратимость процессов вызывается наличием внутреннего трения в рабочем теле и поверхностного трения в техническом оборудовании (течение в сопле, трение поверхности поршня о стенку цилиндра и т.д.). Для преодоления трения всегда необходимо затратить некоторое количество механической работы, которая в ходе процесса превращается в тепло.
ЭНТАЛЬПИЯ. ФИЗИЧЕСКИЕ СВОЙСТВА Энтальпией термодинамического тела называют сумму внутренней энергии u и произведения p v. i = u + pv. Удельная энтальпия равна энергии расширенной системы- тела и окружающей среды. В этом её физический смысл. (81) Дифференцируя данное соотношение получим: di = du + pdv + vdp , (82) или du + pdv = di - vdp . (83) На основе первого закона термодинамики dq = du + pdv последнее соотношение перепишется в виде: dq = di - vdp , (84) или dq = di + dlt, (85) где dlt - есть дифференциал технической работы (dlt = - vdp).
Величина i может также рассматриваться как параметр состояния термодинамического тела наряду с ранее введенными p, v, T, u. Физический смысл величины i может пояснен на основе уравнения (dq = di - vdp), которое для процесса p = const запишется как: dqp = di . Откуда следует, что di есть элементарное количество теплоты, подведенное к термодинамическому телу в процессе постоянного давления.
Изменение энтальпии в любом процессе определяется только начальным и конечным состояниями тела и не зависит от промежуточных состояний и характера процесса.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
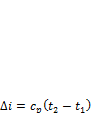
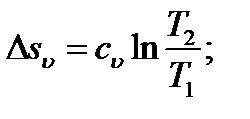
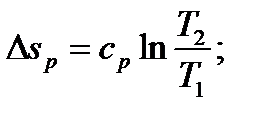

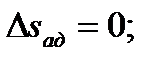
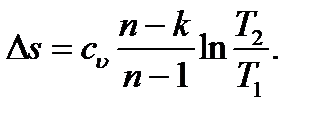
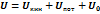
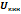 – внутренняя кинетическая энергия молекул,
– внутренняя кинетическая энергия молекул, 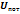 внутренняя потенциальная энергия молекул,
внутренняя потенциальная энергия молекул, 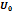 – постоянная интегрирования.
– постоянная интегрирования.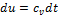
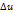 , а не её абсолютное значение; поэтому начало отсчёта (0 К или 00 С) для конечного результата (
, а не её абсолютное значение; поэтому начало отсчёта (0 К или 00 С) для конечного результата ( 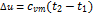
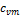 - средняя массовая теплоёмкость при постоянном объёме в пределах
- средняя массовая теплоёмкость при постоянном объёме в пределах 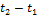
 Полученное уравнение является также второй формулировкой первого закона термодинамики, используя понятия энтальпии и технической работы.
Полученное уравнение является также второй формулировкой первого закона термодинамики, используя понятия энтальпии и технической работы.