
|
|
ЗАПИСЬ В ЛАБОРАТОРНОМ ЖУРНАЛЕ
Масса муки (m)……………………………………..г Величина оптической плотности (D) Содержание белка в навеске муки (по калибровочной кривой)(n/1000)………………г Массовая доля белка в муке (M1)………………….. % Массовая доля белка в 100 г сухих веществ(М)..% Заключение Построение калибровочной кривой - для построения калибровочной кривой подбирают образцы муки с различной массовой долей белка в диапазоне, встречающемся в реальных условиях (от 8 до 20%). Интервал в содержании белка образцов должен находиться в пределах не более 1%. Количество образцов не должно быть менее 10. С увеличением их числа точность определений возрастает. Затем приведенным выше методом Дженнингса определяют оптическую плотность белковых вытяжек всех образцов. При построении кривой на оси абсцисс откладывают величины оптической плотности, а на оси ординат - содержание белка в навеске в мг.
Рис.1 Калибровочная кривая (биуретовый метод). ОПРЕДЕЛЕНИЕ МАССОВОЙ ДОЛИ БЕЛКА НЕФЕЛОМЕТРИЧЕСКИМ МЕТОДОМ Метод основан на измерении интенсивности светового потока, рассеянного твердыми или коллоидными частицами, находящимися в растворе во взвешенном состоянии. По интенсивности светорассеяния, определяемой нефелометром, судят о концентрации исследуемого вещества. В настоящее время находят широкое использование фотоэлектрические нефелометры. Растворы высокомолекулярных соединений, например растворы белков, способны при определенных условиях в присутствии некоторых химических реагентов опалесцировать. Одним из таких реагентов является сульфосалициловая кислота. Концентрация белка в этом случае может быть определена по интенсивности опалесценции. Продукты гидролиза белка—пептоны, аминокислоты и другие азотсодержащие вещества — не опалесцируют. Экспериментальной проверкой установлено, что нефелометрический метод с использованием сульфосалициловой кислоты отличается быстротой, высокой точностью, простотой и хорошей корреляцией с методом Кьельдаля.
ТЕХНИКА ОПРЕДЕЛЕНИЯ
Около 0,5 г исследуемой муки взвешивают с погрешностью ±0,001 и помещают в коническую колбу вместимостью 250—300 ом3, снабженную пробкой. В колбу добавляют из бюретки 50 см 0,05 н. раствора гидроксида натрия. Закрытую пробкой колбу встряхивают на механическом встряхивателе в течение 15 мин. Затем вытяжку центрифугируют 10 мин при частоте вращения 6000 мин-1. 5 см3 прозрачного центрифуга-та пипеткой переносят в мерную колбу на 50 см3 и содержимое колбы доводят до метки сульфосалициловой кислотой. При нефелометрическом анализе получение правильных результатов в значительной мере зависит от методики получения суспензии, в частности от порядка смешивания растворов, скорости смешивания. Поэтому после добавления сульфосалициловой кислоты колбу быстро переворачивают 2—3 раза (не более), раствор наливают в кювету с толщиной слоя 5 мм и измеряют величину оптической плотности раствора при длине волны 550нм. Замеры следует производить сразу после добавления кислоты, так как частицы белка быстро агрегируют. Массовую долю белка определяют по калибровочной кривой (рис.2). Построение ее ведут так же, как и при биуретовом методе. Запись в лабораторном журнале аналогична записи, данной к биуретовому методу. По полученным данным делают заключение.
Рис. 2. Калибровочная кривая (нефелометрический метод).
РЕФРАКТОМЕТРИЧЕСКИЙ МЕТОД Метод основан на установлении разности показателей преломления исследуемого вещества и раствора, полученного после осаждения белков раствором хлористого кальция при кипячении. ТЕХНИКА ОПРЕДЕЛЕНИЯ
отмеривают пипеткой 5мл исследуемого вещества (молока) в пробирку, добавляют 5-6 капель 4%-ного раствора хлористого кальция. Пробирку закрывают пробкой и помещают в баню с кипящей водой на 10 мин. Затем содержимое фильтруют через складчатый фильтр. В прозрачном фильтрате, а также в исходном молоке определяют на рефрактометре показатель преломления при 200С. Содержание белка в молоке (в %) рассчитывают по формуле
где а – содержание белка, %
0,002045 – коэффициент, позволяющий выразить полученную разность показателей преломления, % от общего белка.
СОДЕРЖАНИЕ И ОФОРМЛЕНИЕ ОТЧЕТА ПО РАБОТЕ
Отчет о лабораторной работе оформляется каждым студентом. Текст пишется темными чернилами, эскизы могут выполняться карандашом,графики результатов экспериментов строятся в масштабе. Содержание отчета излагается в порядке, указанном в работе, идолжно включать: - название работы, цель работы, краткое содержание; - краткие выводы по работе. Законченные и оформленные отчеты студенты предъявляют преподавателю, до начала выполнения следующей работы.
ВОПРОСЫ ДЛЯ САМОПРОВЕРКИ 1.Каково значение белков для организма человека. Классификация белков? 2.Свойства белков? 3.Каков принцип определения, белка по методу Кьельдаля и каковы его достоинства и недостатки? 4.В чем заключается принцип биуретового метода определения белка? 5.В чем заключается принцип нефелометрического метода определения белка? 6.В чем заключается принцип нефелометрического метода определения белка? 7.В чем заключается принцип рефрактометрического метода определения белка?
ЛИТЕРАТУРА
1. Фалунина З.И. Лабораторный практикум по общей технологии пищевых продуктов/ З.И. Фалунина. М.: Пищевая промышленность, 1978. 271с. 2. Назаров Н.И. Общая технология пищевых производств/ Н.И. Назаров. М.: Легкая и пищевая технология, 1981.с. 19. 3. Лабораторный практикум по общей технологии пищевых производств/ под ред. Л.П. Ковальской, М.: Агропромиздат, 1991. 335с. 4. Руководство по методам анализа качества и безопасности пищевых продуктов/под ред. И.М. Скурихина, В.А. Тутельяна, М.: Брандес, Медицина. 1998.340с.
Во-вторых, многочисленные исследования выделенного и очищенного вещества (например, белка), ставят в рамки необходимости работать с очень малыми количествами вещества – мг и мкг. Поэтому основными методами исследования являются: - спектрофотометрические, основанные на измерении поглощения видимого или ультрафиолетового света; - радиохимические, основанные на измерении радиоактивности, и люминесцентные, основанные на флюоресценции (био- и хемилюминесценции). В-третьих, многие компоненты обладают очень низкой устойчивостью. Так многие белки, при умеренных температурах и незначительных изменениях рН среды, подвергаются необратимому изменению нативной конформации – денатурации, которая сопровождается потерей биологической активности – инактивацией. Кроме того, в клетках имеются ферменты, способные гидролизовать белки и нуклеиновые кислоты – протеазы и нуклеазы. В неповрежденных клетках эти ферменты сосредоточены главным образом в лизосомах. Однако при разрушении клеток тканей, которое всегда предшествует выделению веществ, лизосомы разрушаются, ферменты выходят, что приводит к быстрому гидролизу биополимеров в биомассе. Выделение индивидуальных биополимеров является многоступенчатым процессом. На каждом этапе разделения должна получаться фракция, более богатая выделяемым веществом. Такой процесс называют фракционированием. Для выделения искомого биополимера из раствора можно воспользоваться осаждением, для этого необходимо понизить растворимость этого биополимера. Так, для осаждения белков добавляют к их водным растворам ацетон. На растворимость белков влияет ионная сила раствора. Высокая концентрация соли приводит к высаливанию. При этом концентрация соли, необходимая для осаждения, различна для различных белков. Наиболее широко для высаливания используется сульфат аммония, обладающий высокой растворимостью и даже высокие концентрации этой соли не вызывают денатурирующего действия на белки. Изменение рН среды для кислых белков в кислую сторону, а для основных – в щелочную приводит их молекулы к изоэлектрической точке. Молекулы лишенные ионной атмосферы сближаются до радиуса действия Ван-дер-Ваальсова притяжения. Иногда это приводит к выпадению белка в осадок. Такой способ выделения называют изоэлектрическим осаждением. Выпавший осадок можно отделить фильтрованием. На начальных стадиях выделения белков из исходной биомассы или осадков нередко используют экстракцию. Например, для выделения из измельченного биологического материала фракции альбуминов применяют экстракцию дистиллированной водой, фракции глобулинов – экстракцию 5-10 %-ными растворами нейтральных солей (хлорида натрия или сульфата аммония), суммарной фракции липидов – серным эфиром и т.д. Многие задачи по разделению веществ решаются с помощью сорбции части компонентов смеси на тех или иных сорбентах (гель фосфата кальция, активированный уголь). Заряженные компоненты можно сорбировать на ионитах – сорбентах, имеющих на поверхности заряженные группы. Разделение может проводиться по размеру частиц с использованием ситового эффекта. Молекулярные сита – это материалы с порами определенного размера. Вещества, молекулы которых меньше размера пор, при пропускании через колонку задерживаются в порах, так как вода, находящаяся там, служит неподвижной фазой для малых частиц. Для больших молекул эти поры недоступны, и они обтекают гранулы, существенно опережая низкомолекулярные компоненты смеси. Во многих методах разделения применяют различные низкомолекулярные вещества (органические растворители, соли, кислоты, щелочи), создающие нужные значения ионной силы и рН, от которых, на определенном этапе выделения и очистки, требуется избавиться. Для этого используется диализ, основанный на применении мембран, проницаемых для воды и низкомолекулярных веществ и непроницаемых для биополимеров.Чаще всего для этого используют пленки из целлофана, представляющие собой нитрат целлюлозы, обладающие прочностью и способностью пропускать молекулы воды и гидрофильных низкомолекулярных компонентов. Для получения индивидуального вещества, из смеси близких по строению веществ, используют зональные методы разделения. Одним из них является хроматография. Используются три группы методов хроматографии: на колонках, на пластинах (тонкослойная) и на бумаге. Вторым зональным методом разделения смесей является электрофорез, основанный на перемещении заряженных частиц в электрическом поле. Зональное разделение можно проводить с помощью седиментации органелл клеток, биополимеров в центробежном поле в ультрацентрифугах. Более тонкие методы разделения основаны на использовании специфического (например, иммунного) сродства биополимера к партнеру получили название аффинных методов разделения. Наиболее широко используемый вариант - использование аффинных сорбентов, которые адсорбируют выделяемое вещество из смеси. После выделения и очистки конкретного вещества используют методы качественного и количественного определения, методы изучения их свойств, структуры и функций. Изучение структур биополимеров, надмолекулярных комплексов осуществляют методами электронной микроскопии и рентгеноструктурного анализа. Выяснение химизма обмена веществ проводят на живых организмах, органах, тканях и клетках животных, растений, микробов методами балансовых опытов, меченых атомов (радиоактивных изотопов) и др.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|


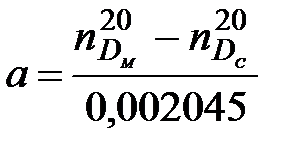 ,
,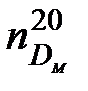 - показатель преломления молока при 200С;
- показатель преломления молока при 200С; - показатель преломления фильтрата при 200С;
- показатель преломления фильтрата при 200С;