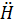|
|
Способы получения аренов.Бензол получают из каменноугольной смолы, образующейся при коксовании угля, из нефти, синтетическими методами.1. Получение из алифатических углеводородов. При пропускании алканов с неразветвленной цепью, имеющих не менее шести атомов углерода в молекуле, над нагретой платиной или оксидом хрома происходит дегидроциклизация— образование арена с выделением водорода: способ Б.А.Казанского и А.Ф.Платэ
2. Дегидрирование циклоалканов. (Н.Д.Зелинский )Реакция происходит при пропускании паров циклогексана и его гомологов над нагретой платиной при 30000 .
3. Получение бензола тримеризацией ацетилена над активированным углём при 6000 (Н.Д.Зелинский)
4.. Сплавление солей ароматических кислот со щелочью или натронной известью:
5.Химические свойства аренов. Бензольное ядро обладает высокой прочностью. Для аренов наиболее характерны реакции, протекающие по механизмуэлектрофильного замещения,обозначаемого символом SE (от англ. substitution electrophilic). По химическим свойствам, бензол занимает промежуточное положение между алканами и алкенами, т.е. как в реакции присоединения, так и в реакции замещения. Химические свойства бензола. 1.Реакции замещения: Галогенирование. Бензол не взаимодействует с хлором или бромом в обычных условиях. Реакция может протекать только в присутствии катализаторов — безводных АlСl3, FeСl3, АlВr3. В результате реакции образуются галогенозамещенные арены:
Роль катализатора заключается в поляризации нейтральной молекулы галогена с образованием из нее электрофильной частицы:
Нитрование. Бензол очень медленно реагирует с концентрированной азотной кислотой даже при сильном нагревании. Однако при действии так называемой нитрующей смеси (смесь концентрированных азотной и серной кислот) реакция нитрования проходит достаточно легко:
Сулъфирование. Реакция легко проходит под действием “дымящей” серной кислоты (олеума):
2. Алкилирование по Фриделю—Крафтсу. В результате реакции происходит введение в бензольное ядро алкильной группы с получением гомологов бензола. Реакция протекает при действии на бензол галогеналканов RСl в присутствии катализаторов — галогенидов алюминия. Роль катализатора сводится к поляризации молекулы RСl с образованием электрофильной частицы:
В зависимости от строения радикала в галогеналкане можно получить разные гомологи бензола:
Алкилирование алкенами. Эти реакции широко используются в промышленности для получения этилбензола и изопропилбензола (кумола). Алкилирование проводят в присутствии катализатора АlСl3. Механизм реакции сходен с механизмом предыдущей реакции:
Все рассмотренные выше реакции протекают по механизму электрофильного замещения SE. Реакции присоединения к аренам приводят к разрушению ароматической системы и требуют больших затрат энергии, поэтому протекают только в жестких условиях. 3.Реакции присоединения, идущие с разрывом связей: Гидрирование. Реакция присоединения водорода к аренам идет при нагревании и высоком давлении в присутствии металлических катализаторов (Ni, Pt, Pd). Бензол превращается в циклогексан, а гомологи бензола — в производные циклогексана:
Радикальное галогенирование. Взаимодействие паров бензола с хлором протекает по радикальному механизму только под воздействием жесткого ультрафиолетового излучения. При этом бензол присоединяет три молекулы хлора и образует твердый продукт — гексахлорциклогексан (гексахлоран) С6Н6Сl6:
4. Окисление кислородом воздуха.По устойчивости к действию окислителей бензол напоминает алканы. Только при сильном нагревании (400 °С) паров бензола с кислородом воздуха в присутствии катализатора V2О5 получается смесь малеиновой кислоты и ее ангидрида:
5.Бензол горит. (Просмотр опыта) Пламя бензола коптящее из-за высокого содержания углерода в молекуле. 2 C6 H6 + 15 O2 → 12CO2 + 6H2O 6.Применение аренов. Бензол и его гомологи применяются как химическое сырье для производства лекарств, пластмасс, красителей, ацетона, фенола, формальдегидных пластмасс. ядохимикатов и многих других органических веществ. Широко используются как растворители. Бензол в качестве добавки улучшает качество моторного топлива.Этилен используют для получения этилового спирта, полиэтилена. Он ускоряет созревание плодов (помидоров, цитрусовых) при введении незначительных количеств его в воздух теплиц. Пропилен используется для синтеза глицерина, спирта, для добывания полипропилена, который идет на изготовление веревок, канатов, упаковочного материала. Исходя из 1-бутену, добывают синтетический каучук. Понятие об алкадиенах как углеводородах с двумя двойными связями. Алкадиены- алифитические(ациклические), непредельные(ненасыщенные) углеводороды, с двумя дойными связями. Общая формула: CnH2n-2. Представитель– пропадиен; Структурная формула: CH2= C =CH2 H H Электронная формула:
Вид гибридизации - sp2 Форма молекулы - плоская. Угол связи -120ο CH2=C=CH-CH3 Бутадиен - 1,2 CH2=CH-CH=CH2 Бутадиен 1,3 Бутадиен-1,3 – легко сжижающийся газ с неприятным запахом, tпл. = -108,90 С, растворяется в эфире, бензоле, не растворяется в воде.
Для алкадиенов характерны реакции горения, присоединения, обесцвечивания водного раствора перманганата калия и бромной воды.
Важной особенностью алкадиенов является большая легкость их к полимеризации. Эта реакция лежит в основе получения синтетических каучуков. n Н2С = СН – СН = СН2 → (…– Н2С – СН = СН – СН2 –…) n бутадиен-1,3 (дивинил) синтетический бутадиеновый каучук. Резина — эластичный материал, получаемый вулканизацией каучука.
Контроль знаний: 1. Какие соединения называются аренами? 2. Какие характерные физические свойства? 3. В какие химические реакции вступает бензол? 4. Дайте характеристику алкадиенам.
Литература: 1.Габриелян О.С. Химия. 11 класс. Базовый уровень: учеб. для общеобразоват. учреждений. – М., 2010, 2. Габриелян О.С. Химия: учеб. для студ. сред. проф. учеб. заведений.- 2-е издание / О.С. Габриелян, И.Г. Остроумов. – М., 2013. 3. http://ru.wikipedia.org- энциклопедия 4. .Рудзитис Г.Е., Фельдман Ф.Г, химия. 10 класс: учебник для общеобразовательных учреждений (базовый уровень). – М.: Просвещение, 2016.
Самостоятельная работа №6 Тема: Природный газ. Природный газ как топливо. Преимущества природного газа перед другими видами топлива. Состав природного газа. Каменный уголь. Коксохимическое производство и его продукция. Нефть. Состав и переработка нефти. Нефтепродукты. Бензин и понятие об октановом числе. Основные понятия и термины по теме: нефть,природный газ, продукты перегонки нефти, перегонка нефти, детонационная стойкость бензина, виды топлива, применение природных источников углеводородов. План изучения темы (перечень вопросов, обязательных к изучению):
1.Природный газ. Природный газ как топливо. 2. Нефть. Состав, свойства нефти. Продукты перегонки нефти, их применение. Детонационная стойкость бензина. 3. Каменный уголь, продукты его переработки. 4. Основные виды топлива и их значение в энергетике страны. Содержание: 1. Природный газ. Природный газ как топливо.
Сопутствующий нефтяной газ отличается по составу от природного: в нем содержится меньше метана (30-59% по объему), но больше этана, пропана, бутана, пентана (7-20% по объему) и высших углеводородов, чем в природном газе. Ранее сопутствующий газ не находил применения и во время добычи нефти сжигали факельным способом. При переработке попутного нефтяного газа сначала отделяют жидкие легко кипящие углеводороды - пентан, гексан и др. Они вместе образуют так называемый газовый бензин (газолин), который используется как добавка к обычным бензинам для лучшего их воспламенения при запуске двигателей. Затем отделяется пропан-бутановая смесь, которой заполняют баллоны под давлением. Сжиженный газ используется как газообразное топливо, что остается после отделения газового бензина и бутан-пропановой смеси, состоящий преимущественно из метана и используется как топливо. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|










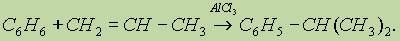



 ::C::
::C::