
|
|
НАПРАВЛЕННОСТЬ РЕАКЦИЙ В РАСТВОРАХ ЭЛЕКТРОЛИТОВВ растворах электролитов реакции всегда идут в сторону образования наименее диссоциированных или наименее растворимых веществ. Из этого, в частности, следует, что сильные кислоты вытесняют слабые из растворов их солей: CH3COONa + HCl = CH3COOH + NaCl Суть этой реакции более точно отражается ионно-молекулярным уравнением, где формулы слабых электролитов записаны в виде молекул, а сильных – в виде ионов: CH3COO– + Na+ + H+ + Cl– = CH3COOH + Na+ + Cl– или в сокращенном виде: CH3COO– + H+ = CH3COOH Сокращенное ионное уравнение отражает самую суть происходящего процесса. Вступают в реакцию или образуются в ней в действительности только те частицы (ионы или молекулы), которые записаны в сокращенном уравнении. Аналогично протекают реакции между сильными основаниями и солями слабых оснований. Например: FeSO4 + 2 NaOH = Na2SO4 + Fe(OH)2 Fe2+ + SO42– + 2 Na+ + 2 OH– = SO42– + 2 Na+ + Fe(OH)2 Fe2+ + 2 OH– = Fe(OH)2 При составлении ионно-молекулярных уравнений необходимо помнить: 1) в ионном виде записываются только хорошо растворимые сильные электролиты: растворимые соли, сильные кислоты ,основания, образованные щелочными и щелочноземельными металлами, поскольку в растворе такие соединения присутствуют только в виде ионов; 2) малорастворимые вещества, слабые электролиты и неэлектролиты записываются в виде молекул, поскольку концентрация ионов, образующихся за счет их диссоциации, в растворе очень мала, основная форма существования соединений - молекулы. Таким образом, при написании ионно-молекулярных уравнений необходимо знать растворимость и силу электролитов. Zn(OH)2 + 2HCl = ZnCl2 + 2H2O Zn(OH)2 + 2H+ + 2Cl–= Zn+2 + 2Cl– + 2H2O или уравнение в сокращенном виде Zn(OH)2 + 2H+ = Zn2+ + 2H2O NH4Cl + H2O = NH4OH + HCl NH или уравнение в сокращенном виде NH AgCl + 2NH3 = [Ag(NH3)2]Cl AgCl + 2NH3 = [Ag(NH3)2]+ + Cl– [Ag(NH3)2]Cl + 2KCN = Ag(CN)2] + KCl + 2NH3 Реакции с участием малорастворимых веществ в молекулярной и ионно-молекулярной форме:
AgNO3 + KCl = AgCl¯ + KNO3 уравнение в сокращенном виде: Ag+ + Cl– = AgCl¯
СаСО3 + 2НCl = СаСl2 + СО2 + Н2О СаСО3 + 2Н+ + 2Cl– = Са2+ + 2Сl– + СО2 + Н2О, уравнение в сокращенном виде СаСО3 + 2Н+ + = Са2+ + СО2 + Н2О. Большинство процессов в растворах электролитов обратимы. Равновесие всегда смещено в сторону образования более устойчивых форм, то есть более слабых электролитов или наименее растворимых веществ, более устойчивых комплексных ионов. Для решения вопроса о глубине и направленности процессов в общем случае нужно рассчитывать изменение энергии Гиббса. Судить о направленности реакций в растворах электролитов можно также по другим термодинамическим характеристикам: константам равновесия процессов диссоциации слабых электролитов, константам равновесия распада или образования комплексных соединений, ПР малорастворимых электролитов. Так, процесс нейтрализации сильной кислоты сильным основанием, записанный в виде молекулярного уравнения HCl + NaOH = NaCl + H2O, или ионно-молекулярного Н+ + ОН– = H2O , характеризуется изменением энергии Гиббса, которое можно рассчитать по уравнению
если Т = 298 К, а СН
Значение изменения энергии Гиббса свидетельствует о большой термодинамической вероятности процесса. Процесс взаимодействия соли слабой кислоты с более сильной кислотой с образованием слабой кислоты также характеризуется отрицательной величиной NaClO + H2SO4 = Na2SO4 + 2HClO ClO– + H+ = HClO
Результат термодинамического расчета хорошо согласуется с известным правилом: более сильная кислота вытесняет слабую из растворов её солей. Рассмотрим процесс нейтрализации слабой кислоты щелочью при стандартных условиях: HClO + NaOН = NaCl + H2O. Запишем процесс в ионно-молекулярной форме, по которой удобно проводить расчет: HClO + OН– = ClO– + H2O. Изменение энергии Гиббса
Если умножить числитель и знаменатель дроби на СН
и тогда
В растворе возможна перестройка комплексных соединений с заменой лигандов при сохранении иона-комплексообразователя. В качестве примера рассмотрим процесс: [Ag(NH3)2]NO3 + 2KCl = K[AgCl2] + 2NH3
[Ag(NH3)2]+ + 2С1– = [AgCl2]– +2NH3 К = Учитывая, что Кнест.[AgCl К = и тогда
Если в реакции участвуют малорастворимые электролиты, а также слабые электролиты, то непосредственно сравнивать величины ПР и Кдисс.. слабого электролита для решения вопроса о возможности осуществления процесса нельзя, следует проводить расчет констант равновесия суммарного процесса или расчет изменения энергии Гиббса. Рассмотрим процесс растворения сульфида меди в соляной кислоте при стандартных условиях: [CuS] + 2{HCl}ag = {CuCl2} + (H2S)ag, уравнение в ионно-молекулярной форме записывается [CuS] + 2{H+}ag = {Cu+2}ag + (H2S)ag Сульфид меди малорастворим, ПРCuS = 3,2 × 10–38, сероводород в воде диссоциирует как слабая кислота. Кдисс. H [CuS] + 2{H+}ag = {Cu+2}ag + (H2S)
S Изменение энтальпии в соответствии со следствием из закона Гесса рассчитывается по уравнению:
Изменение энтропии соответственно: DS
Рассчитанное изменение энергии Гиббса для процесса в прямом направлении свидетельствует о термодинамической невозможности растворения CuS в соляной кислоте. Правильность вывода, сделанного на основании термодинамического расчета, подтверждается экспериментальными данными, сульфид меди в соляной кислоте не растворяется.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
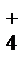 + Cl– + H2O = NH4OH + H+ + Cl–
+ Cl– + H2O = NH4OH + H+ + Cl– = –RTlnKс = –RTln
= –RTlnKс = –RTln  ,
, × СОН
× СОН  =
=  = 10–14, то для стандартных условий получим
= 10–14, то для стандартных условий получим = –8,314 298 2,303lg1014 = –8,314×298 2,303 14 = –79,88 кДж.
= –8,314 298 2,303lg1014 = –8,314×298 2,303 14 = –79,88 кДж. ;
;  =
= 


 =
=  =
=  = 107
= 107 .
. ]
]  =
=  = 1,76 10–5, а Кнест.
= 1,76 10–5, а Кнест.  =
=  = 9,3 10–8, легко показать, что
= 9,3 10–8, легко показать, что ×
×  =
=  ,
, . Расчет дает величину
. Расчет дает величину , откуда
, откуда  и S
и S  всех частиц, участвующих во взаимодействии.
всех частиц, участвующих во взаимодействии. =
= 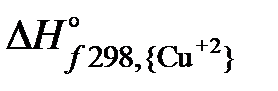 +
+ 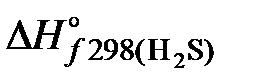 –
–  – 2
– 2  = 66,99 –20,1 + 53,1 = 100 кДж.
= 66,99 –20,1 + 53,1 = 100 кДж.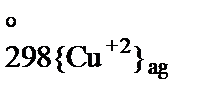 + S
+ S  – S
– S  – S
– S  = –92,8 + 205,6 – 66,5= 46,3 Дж/моль К. Тогда стандартное изменение энергии Гиббса:
= –92,8 + 205,6 – 66,5= 46,3 Дж/моль К. Тогда стандартное изменение энергии Гиббса: =
=