
|
|
Направленность химических процессовДля учета одновременного влияния энтальпийного (DН) и энтропийного (DS) факторов при постоянных давлении и температуре используют так называемую энергию Гиббса (свободную энергию, uзобарно-uзоmермический потенциал): DG = DН – Т DS, или для стандартных условий: DG где DG Расчет изменения стандартной энергии Гиббса обычно проводят по приближенному уравнению: DG Обозначения: DG DG DG Единицы измерения DG Для расчета DG 1) записать соответствующий процесс, указав агрегатные состояния веществ, участвующих в реакции; 2) расставить стехиометрические коэффициенты; 3) выписать из справочника величины стандартных теплот образования и стандартных энтропий всех участвующих в реакции веществ в соответствующих агрегатных состояниях; 4) рассчитать значения DН 5) При расчете DG DG По величине изменения энергии Гиббса в реакции можно судить о принципиальной термодинамической возможности осуществления процесса. Термодинамика утверждает, что в любой закрытой системе при постоянном давлении и температуре возможен только такой самопроизвольный процесс, который ведет к уменьшению энергии Гиббса (DG <0). При значениях DG >0 процесс термодинамически невозможен. При DG = 0 система находится в состоянии равновенсия. Если условия протекания процесса отличаются от стандартных, то используют величину DG. Значений DG для процесса может быть получено множество в отличие от единственного значения DG а А + в В = с С + d D записывается в виде: DG = DGо + RT ln (PAa PBb/ PCc PDd) или DG = DGо + RT ln (CAa CBb/ CCc CDd) Где Р – относительные парциальные давления соответствующих веществ; С концентрации соответствующих растворенных веществ. Если концентрации либо парциальные давления веществ, участвующих в реакции = 1, то DG = DGо. При равновесии DG = 0, а выражение под логарифмом преобразуется в Кр (Кс для растворов). Отсюда получаем одно из важнейших уравнений термодинамики, связывающее константу химического равновесия с изменением стандартной энергии Гиббса: DG Если в уравнение подставить значение постоянной R = 8,314 Дж/(моль К) и ввести коэффициент перехода от натурального к десятичному логарифму 2,303, то выражение можно записать следующим образом: DG Поскольку D G –RTlnKp » DН Используя уравнение изотермы для любой реакции при некоторых произвольно выбранных значениях давления и температуры можно рассчитать DG (бесконечное множество значений) и сделать вывод о термодинамической вероятности протекания этой реакции при выбранных условиях. Анализ многочисленных экспериментальных данных показал, что при реальных изменениях условий (парциальных давлений или концентраций реагирующих веществ) второе слагаемое в уравнении изотермы Вант-Гоффа не превышает 40 кДж (≤ 40 кДж). Это означает, что если /DGоТ/ > 40 кДж, то вывод о возможности или невозможности протекания реакции в любых реальных условиях можно сделать просто по знаку DGоТ. Процесс термодинамически невозможен как самопроизвольный при DG Если DG Значения DG При условии DG Т =
Вклады энтальпийного и энтропийного факторов существенно зависят от температуры. 1) Если Т → 0, то DG 2) Если Т → ∞, то DG Таким образом, в зависимости от температуры влияние либо энтальпийного, либо энтропийного факторов на значение и знак DG
Табл. 1. - Влияние температуры на направление химических реакций
График зависимости DG оттемпературы 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
 = DН
= DН  – ТDS
– ТDS  – стандартная энергия Гиббса образования веществ и ионов из простых веществ. DG
– стандартная энергия Гиббса образования веществ и ионов из простых веществ. DG 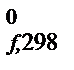 – изменение энергии Гиббса реакции образования 1 моля вещества из простых веществ при условии, что все участники реакции находятся в стандартных состояниях.
– изменение энергии Гиббса реакции образования 1 моля вещества из простых веществ при условии, что все участники реакции находятся в стандартных состояниях. – кДж.
– кДж. =–RT 2,303lgKp=–19,15TlgKp.
=–RT 2,303lgKp=–19,15TlgKp. .
.