
|
|
ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИРастворение твердых электролитов прекращается, когда образуется насыщенный раствор, в котором устанавливается гетерогенное равновесие между твердой фазой и перешедшими в раствор ионами. Например: [CaSO4] В выражение константы этого гетерогенного равновесия не входит концентрация твердой фазы K = C(Ca2+)∙(SO42–) В насыщенном растворе твердого электролита произведение концентраций его ионов есть величина постоянная при данной температуре. Она называется произведением растворимости. ПР(CaSO4) = C(Ca2+)∙(SO42–) Если молекула электролита содержит несколько одинаковых ионов, то концентрации этих ионов, согласно закону действующих масс, должны быть возведены в соответствующие степени. Например: [PbI2] ПР(PbI2) = C(Pb2+)∙C(I–)2 Зная произведения растворимости, можно решать вопросы, связанные с образованием или растворением осадков при химических реакциях. Например, пусть диссоциация соли АВ происходит на два иона: АВ Обозначив растворимость через s (моль/л), получим C(A+)= C(B‑) =s, ПР=s2. На практике чаще возникает обратная задача определения растворимости. Для соли, диссоциирующей на два иона, AB2 В этом случае C(A2+)=s, C(B–)=2s, ПР= s (2s)2=4s3, Если фактическое произведение концентраций (ПС) ионов в некотором растворе превышает значение произведения растворимости, т.е. ПС>ПР, то раствор является пересыщенным, и из него выпадает осадок. Условие растворения осадка (ненасыщенности раствора): ПС<ПР. Оба процесса идут с одинаковой скоростью, и система приходит в состояние равновесия при ПС=ПР (насыщенный раствор). ПРИМЕР 1. Вычислить массу хромата серебра, находящуюся в его насыщенном растворе объемом 1 л. ПР(Ag2CrO4) = 4,05·10-12. РЕШЕНИЕ. Равновесие растворимости в насыщенном растворе Ag2CrO4: [Ag2CrO4] + aq ПР = С2Ag+·СCrO42- = 4,05·10-12. Пусть Со (Со = s) – концентрация насыщенного раствора Ag2CrO4. Соль Ag2CrO4 – сильный электролит, α ≈ 1. СAg+ = Со·α·n = 2Со; СCrO42-= Со, так как α = 1, n = 1. Получаем ПР = (2Со)2·Со = 4Со3, откуда Со = 3√4,05·10-12/4 = 1,004·10-4 моль/л. Поскольку Со = m/М·V, m(Ag2CrO4) = Со·М ·V = 1,004 ·10-4· 332 · 1 = 3,3·10-2г. Полученные данные позволяют вычислить объем воды, необходимый для растворения определенной навески соли. ПРИМЕР 2. Вычислить объем воды, необходимый для растворения 50 мг хромата серебра. РЕШЕНИЕ. Воспользуемся результатами, полученными в примере 1, согласно которым в 1 л насыщенного раствора Ag2CrO4 содержится 3,3·10-2г Ag2CrO4. При такой низкой концентрации соли объем насыщенного раствора практически равен объему воды. Таким образом, в 1 л воды растворяется 3,3·10-2г Ag2CrO4, в х л воды растворяется 0,05г Ag2CrO4. х = 0,05/0,033 = 1,52л. Если в равновесную систему (1), содержащую в растворе ионы My+, Ax- и твердую фазу МхАy, ввести электролит, имеющий в составе либо My+, либо Ax-, то это, в соответствии с принципом Ле Шателье, приведет к образованию дополнительного количества осадка. Следовательно, присутствие одноименного иона понижает растворимость малорастворимого электролита. Величина ПР, как всякая константа равновесия, зависит только от природы электролита и температуры и не изменяется с изменением концентраций ионов в насыщенном растворе. ПРИМЕР 3. Определить растворимость хлорида серебра в чистой воде и в 0,1М растворе хлорида натрия. ПР(AgCl) = 1,56·10-10. РЕШЕНИЕ. В насыщенном растворе AgCl устанавливается равновесие: [AgCl] + aq ПР = СAg+·СCl- = 1,56·10-10. При отсутствии других электролитов в системе концентрации ионов Ag+ и Cl- одинаковы: СAg+ = СCl- = Со. ПР = СAg+·СCl- = Со2. Растворимость AgCl в чистой воде: Со =√ПР = √1,56·10-10 = 1,25·10-5 моль/л. Увеличение концентрации ионов Cl‑ за счет введения в раствор NaCl приведет к смещению равновесия (3) влево, к уменьшению концентрации ионов Ag+ за счет образования дополнительного количества осадка. Равновесная концентрация ионов Cl‑будет слагаться из концентрации ионов Cl‑ за счет диссоциации растворенной части AgCl и ионов Cl-, образующихся за счет диссоциации NaCl: Обозначим растворимость AgCl в 0,1 М растворе NaCl через С1 (моль/л). Тогда СAg+ = С1·α = С1. ПР = С1· 0,1 = 1,56·10-10. С1 = Значение С1 значительно меньше Со.
Значения ПР используются также для определения условий образования осадков. Рассмотрим возможность образования осадка МхАy: x{My+}aq + y{Ax-}aq Обозначим произведение произвольно выбранных концентраций ионов, входящих в выражение константы равновесия как ПС: ПС = СхMy+·СуAx- . Условием образования в системе осадка является неравенство ПС МхАy > ПР МхАy, т.е. осадок выпадает в том случае, когда произведение концентраций ионов, образующих малорастворимый электролит, в степенях, равных стехиометрическим коэффициентам, будет больше произведения растворимости. При ПС МхАy < ПР МхАy осадок в системе не образуется. ПРИМЕР 4. Будет ли выпадать осадок при смешивании 100 мл 0,02М раствора нитрата свинца с 200 мл 0,2н. раствора соляной кислоты. РЕШЕНИЕ. В осадок может выпасть малорастворимый PbCl2. В исходных растворах концентрация ионов Pb2+ = 0,02моль/л, CCl- = 0,2 моль/л. При смешивании растворов концентрация ионов Pb2+ уменьшится в 3 раза и составит 0,02/3 = 0,0067 моль/л, CCl- =0,2·2/3 = 0,133 моль/л, поскольку раствор, содержащий Cl- ионы разбавили от 200 до 300 мл. ПС PbCl2= СPb2+·С2Cl- = 0,0067 · (0,133)2 = 1,19·10-4. ПР PbCl2 = 2,12·10-5. ПСPbCl2 > ПРPbCl2. Осадок выпадает
Гидролиз солей Обменное взаимодействие соли с водой, приводящее к образованию слабого электролита, называется гидролизом солей. Суть гидролиза солей заключается в том, что происходит смещение равновесия диссоциации воды вследствие связывания одного из ее ионов с образованием малодиссоциированного или труднорастворимого продукта. Гидролиз идет по-разному в зависимости от силы кислоты и основания, образовавших соль. Гидролизу подвергаются растворимые соли, образованные: а) слабой кислотой и сильным основанием; б) слабым основанием и сильной кислотой; в) слабым основанием и слабой кислотой. В гидролизе участвуют катионы слабого основания и анионы слабой кислоты, в большинстве случаев гидролиз – процесс обратимый, протекает ступенчато. Гидролиз приводит к изменению рН среды. Уравнения реакций гидролиза составляют в молекулярной и ионно-молекулярной формах. Соли, образованные слабым основанием и сильной кислотой, и соли, образованные слабой кислотой и сильным основанием, в обычных условиях подвергаются гидролизу в незначительной степени. Вторая и последующие ступени, если они возможны, почти не протекают, поэтому при рассмотрении процесса гидролиза, выше названных солей ограничиваются первой ступенью. Например, гидролиз соли Na2CO3 в растворе:
гидролизу подвергается анион слабой кислоты: CO в молекулярной форме: Na2CO3 + H2O « NaНCO3 + NaОН; в растворе соли избыток ионов ОН-, среда щелочная, рН > 7. Гидролиз соли ZnSO4 в растворе:
гидролизу подвергается катион слабого основания: Zn2+ + H2O в молекулярной форме: 2ZnSO4 + 2H2O в растворе соли избыток ионов Н+, среда кислая, рН < 7. Гидролиз соли, образованной слабым основанием и слабой кислотой, протекает, как правило, до конца; в результате образуются слабое основание и слабая кислота:
Гидролизу подвергаются катионы слабого основания и анионы слабой кислоты:
Образующиеся ионы Н+ и ОН- нейтрализуют друг друга, что вызывает смещение равновесия в сторону усиления гидролиза. Вследствие этого становится возможным протекание следующих ступеней гидролиза:
По указанной выше причине протекет и третья ступень гидролиза: Al(OH) Суммарное ионно-молекулярное уравнение имеет вид: 2Al3+ + 3S2- + 6H2O = 2Al(OH)3 + H2S или в молекулярном виде: Al2S3 + 6H2O = 2Al(OH)3 + 3H2S. Таким образом, сульфид алюминия гидролизуется в растворе полностью и необратимо с образованием нерастворимого гидроксида Al(OH)3 и слабой кислоты H2S. рН раствора близок к 7. Характер среды (слабокислая или слабощелочная) определяется константой диссоциации слабого основания или слабой кислоты по первой ступени. При сливании водных растворов двух солей, имеющих разную природу, т.е. одна образована слабой кислотой и сильным основанием, а другая – слабым основанием и сильной кислотой, происходит совместный гидролиз этих солей. Одна соль гидролизует по аниону, а другая – по катиону. Образующиеся в результате гидролиза ионы ОН- и Н+ нейтрализуют друг друга, и равновесие каждой из ступеней гидролиза смещается вправо, т.е. гидролиз усиливается и в некоторых случаях идет до конца, например: Al2(SO4)3 + 3Na2SO3 + 6H2O = 2Al(OH)3 + 3Н2SO3 + 3Na2SO4; в ионно-молекулярной форме уравнение гидролиза имеет вид: 2Al3+ + 3SО

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|
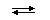 {Ca2+} + {SO42–} (1)
{Ca2+} + {SO42–} (1)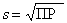 . Значения ПР можно найти в химических справочниках, справочные величины табулируются обычно при 298К. Например, ПР(AgCl)=1,56∙10–10, ПР(AgBr)=4,4∙10–13, ПР(BaSO4)=1,1∙10–10, ПР(HgS)=4∙10–53. Если соль имеет общую формулу AB2, то она диссоциирует по уравнению:
. Значения ПР можно найти в химических справочниках, справочные величины табулируются обычно при 298К. Например, ПР(AgCl)=1,56∙10–10, ПР(AgBr)=4,4∙10–13, ПР(BaSO4)=1,1∙10–10, ПР(HgS)=4∙10–53. Если соль имеет общую формулу AB2, то она диссоциирует по уравнению: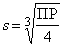 .
. =
= 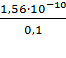 = 1,56·10-9 моль/л.
= 1,56·10-9 моль/л.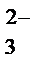
 + ОН- (І ступень);
+ ОН- (І ступень);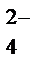
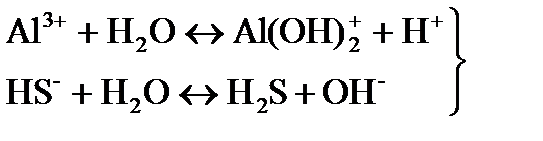 (І ступень)
(І ступень)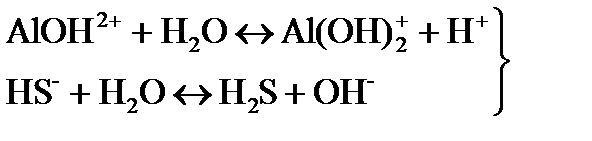 (II ступень)
(II ступень) + H2O = Al(OH)3 + Н+ (III ступень).
+ H2O = Al(OH)3 + Н+ (III ступень). + 6H2O = 2Al(OH)3 + 3Н2SО3.
+ 6H2O = 2Al(OH)3 + 3Н2SО3.