|
Количественная характеристика электролиза выражается двумя законами Фарадея
1. Масса вещества, выделяющегося на электродах, прямо пропорциональна количеству прошедшего через электролит электричества.
2. При электролизе различных химических соединений равные количества электричества выделяют на электродах массы веществ, пропорциональные молярным массам их эквивалентов.
Согласно этим законам:
1.m = Kэ Q или m = Kэ I t , где m – масса выделившегося вещества
Q – количество электричества в кулонах / Кл /
I - сила тока в амперах / А /
t - время в секундах / с /
Kэ - коэффициент пропорциональности, называемый электрохимическим эквивалентом
Если I = 1 A, t = 1 c и, следовательно Q = 1 Кл, то m = Kэ , т.е. электрохимический эквивалент – это масса вещества, выделившегося на электроде током силой в 1 А в течение 1 с или количеством вещества 1 Кл,
Kэ =  , тогда m = , тогда m =  I t , а Мэ = I t , а Мэ =  , где М- молярная масса вещества, а n – число электронов, перемещаемых при окислении или восстановлении , где М- молярная масса вещества, а n – число электронов, перемещаемых при окислении или восстановлении
2.96500 Кл или 26,8 А / ампер-час / выделяют на электродах молярную массу эквивалента данного вещества. Это количество электричества называют числом или постоянной Фарадея F / Кл/моль или А час/ моль /
Вследствие параллельных побочных процессов масса вещества, получаемого при электролизе, оказывается меньше той, которая соответствует количеству прошедшего электричества. Отношение массы реально выделенного вещества на электроде к теоретической и умноженной на 100, называют выходом по току:
Вт =  100 . Так как m = Kэ I t или m = 100 . Так как m = Kэ I t или m =  I t ; Вт = I t ; Вт =  100% 100%
Пример 7.
Для водного раствора данного электролита:
- напишите уравнения процессов, которые идут на электродах при электролизе;
- рассчитайте, сколько и каких веществ выделится на катоде и аноде, если электролиз вести при силе тока, равной I = …. A, в течение t часов и выходу по току Вт;
- определите, как изменится анодный процесс, если анод заменить на другой, указанный в таблице
| AgNO3
| рН=10
| графитовые
| 0,85
|
| 0,5
| цинковые
|
Решение:
Нитрат серебра диссоциирует: AgNO3 ↔ Ag+ + NO3-
- процессы, протекающие на электродах:
Катод (-) Ag+ + e- ® Ag0
Анод (+) выполнен из графита при рН=10 4 OH- - 4 e- ® O2 + 2 H2O
Анод (+) выполнен из цинка идет процесс растворения цинкового анода:
Zn - 2 e- ® Zn2+, таким образом при электролизе раствора нитрата серебра AgNO3, образуется Ag0, O2 и H2O.
- рассчитаем массу серебра и объем кислорода, образовавшихся при электролизе раствора AgNO3 при силе тока равной 15А, времени 0,5 часа с учетом выхода по току, равным 0,85.
Мэ Ag =  = 108 г/моль. Определяем массу серебра, которая бы выделилась теоретически при прохождении через раствор AgNO3 данного количества электричества, учитывая, что 0,5 часа равняется 1800 секундам. = 108 г/моль. Определяем массу серебра, которая бы выделилась теоретически при прохождении через раствор AgNO3 данного количества электричества, учитывая, что 0,5 часа равняется 1800 секундам.
mAg =  I t = I t = 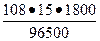 = 30,2(г), так как Вт = 0,85, = 30,2(г), так как Вт = 0,85,
то mAg = 30,2 х 0,85 = 25,67 (г).
Определяем объем кислорода, который бы выделился теоретически при прохождении через раствор AgNO3 данного количества электричества, учитывая, что 0,5 часа равняется 1800 секундам, при силе тока, равной 15А.
VO2 =  I t = I t =  = 1,56(л), так как Вт = 0,85, = 1,56(л), так как Вт = 0,85,
то VO2 = 1,56 х 0,85 = 1,32 (л).
Контрольные задания для выполнения контрольной работы студентам заочной формы обучения
1. Подберите коэффициенты в схеме окислительно-восстановительной реакции, составьте схему электронного баланса, определите, что является – окислителем, что – восстановителем, определите тип окислительно-восстановительной реакции: (таблица 1)
2. Для данной гальванической пары элементов: (таблица 2)
- определите анод и катод;
- напишите уравнения процессов, протекающих на аноде и катоде в работающем гальваническом элементе. Запишите уравнение токообразующей реакции;
- рассчитайте э.д.с. гальванического элемента.
- в каком направлении будут перемещаться электроны во внешней цепи при работе этого гальванического элемента.
3. Для водного раствора данного электролита: (таблица 3)
-напишите уравнения процессов, которые идут на электродах при электролизе;
- рассчитайте, сколько и каких веществ выделится на катоде и аноде, если электролиз вести при силе тока, равной I = …. A, в течение t часов и выходу по току Вт;
- определите, как изменится анодный процесс, если анод заменить на другой, указанный в таблице
4. Для пары металлов: (таблица 4)
- определите, возможна ли коррозия при контакте с воздухом;
- напишите уравнения анодного и катодного процессов, разобрав примеры водородной и кислородной деполяризации при заданном значении рН среды;
- предложите для коррозируемого металла анодное и катодное покрытие.
5. Установить в каком направлении возможно самопроизвольное протекание реакции: (таблица 5).
* При выполнении заданий контрольной работы воспользуйтесь данными таблицы 6 (Стандартные окислительно-восстановительные потенциалы при 25 0С).
Таблица 1
| Номер варианта
| Схема окислительно-восстановительной реакции
| |
| KMnO4 + KOH → O2 + K2MnO4 + H2O
| |
| Rb + H2O → RbOH + H2
| |
| H2S + HNO3 → H2SO4 + NO2 + H2O
| |
| CuI2 → CuI + I2
| |
| Au2O3 → Au + O2
| |
| HCl + CrO3 → CrCl3 + Cl2 + H2O
| |
| KNO2 + KСlO3 → KCl + KNO3
| |
| Cu + H2SO4 → CuSO4 + SO2 + H2O
| |
| HClO3 → ClO2 + HClO4
| |
| Ag + HNO3 → AgNO3 + NO2 + H2O
| |
| HBr + H2SO4 → Br2 + SO2 + H2O
| |
| Cu + HNO3 → Cu(NO3)2 + NO2 + H2O
| |
| S + KOH → K2SO3 + K2S + H2O
| |
| NH3 + O2 → N2 + H2O
| |
| Cl2 + Br2 + KOH → KCl + KВrO3 + H2O
| |
| N2H4 → N2 + NH3
| |
| CuO + NH3 → Cu + N2 +H2O
| |
| Mg + H2SO4 → MgSO4 + H2S + H2O
| |
| NaI + KМnO4 + KOH → I2 + K2MnO4 + NaOH
| |
| HCl + KМnO4 → MnCl2 + Cl2 + KCl + H2O
| |
| MnO2 + O2 + KOH → K2MnO4 + H2O
| |
| AgNO3 → Ag + NO2 + O2
| |
| Ag 2O → Ag + O2
| |
| F2 + H2O → HF + O2
| |
| Cl2 + H2S + H2O → HCl + H2SO4
|
Таблица 2
| Номер варианта
| Гальваническая пара
| |
| Ag | Ag+(0,1M) ║ Zn2+ (0,001M)| Zn
| |
| Ni | Ni2+(0,01M) ║ Zn2+ (0,01M) | Zn
| |
| Ni | Ni2+(10-3 M) ║ Fe2+(10-4M) | Fe
| |
| Zn | Zn2+(10-3моль/л)║ Cu2+(10-2моль/л) | Cu
| |
| Al | Al3+(10-3моль/л)║ Ag+(10-2моль/л) | Ag
| |
| Al | Al3+(10-2моль/л)║ Ag+(10-1моль/л) | Ag
| |
| Cu | Cu2+(10-4моль/л)║ Cu2+(10-1моль/л) | Cu
| |
| Ni | Ni2+(10-2моль/л)║ Cd2+(10-5моль/л) | Cd
| |
| Zn | Zn2+(10-3моль/л)║ Cu2+(10-3моль/л) | Cu
| |
| Cd | Cd2+(10-3моль/л)║ Sn2+(10-4моль/л) | Sn
| |
| Mn | Mn2+( 10-1 моль/л )║ Zn2+(10-2 моль/л) | Zn
| |
| Ni | Ni2+ ( 0,1 моль/л)║ Cd2+ ( 0,001 моль/л) | Cd
| |
| Zn | Zn2+ ( 0,01 моль/л)║ Ag+ ( 0,1 моль/л) | Ag
| |
| Cu | Cu2+ ( 0,01 моль/л)║ Pb2+ ( 0,001 моль/л) | Pb
| |
| Cu | Cu2+ ( 0,01 моль/л)║ Ag+ ( 0,01 моль/л) | Ag
| |
| Ni | Ni2+ ( 0,01 моль/л)║ Pb2+ ( 0,1 моль/л) | Pb
| |
| Cd | Cd2+ ( 0,01 моль/л)║ Cu2+ ( 0,01 моль/л) | Cu
| |
| Pb | Pb2+ ( 0,1 моль/л)║ Cu2+ ( 0,001 моль/л) | Cu
| |
| Pb | Pb2+ ( 0,1 моль/л)║ Cu2+ ( 0,01 моль/л) | Cu
| |
| Cu | Cu2+ ( 0,1 моль/л)║ Cu2+ ( 0,001 моль/л) | Cu
| |
| Al | Al3+ (0,1 моль/л)║ Ag+ (0,0001 моль/л) | Ag
| |
| Ni | Ni2+ (0,01 моль/л)║ Ni2+ ( 0,0001 моль/л) | Ni
| |
| Ni | Ni2+ ( 0,01 моль/л)║ Cd2+ ( 0,001 моль/л) | Cd
| |
| Zn | Zn2+ (0,01 моль/л)║ Cu2+ ( 0,001 моль/л) | Cu
| |
| Ag | Ag+ (0,01 моль/л)║ Cu2+ ( 0,001 моль/л) | Cu
|
Таблица 3
| Номер варианта
| Электролит
| Электроды
| Вт
| I, A
| t, ч
| Замена
анода
| pH
| |
| MnCl2
| медные
| 0,9
|
| 2,5
| графит
|
| |
| NiCl2
| никелевые
| 0.75
|
|
| графит
|
| |
| CuSO4
| никелевые
| 0.85
|
|
| графит
|
| |
| CdCl2
| кадмиевые
| 0.95
|
|
| платина
|
| |
| Ni(NO3)2
| оловянные
| 0.90
|
| 0,5
| графит
|
| |
| Сu(NO3)2
| медные
| 0.85
|
| 0,5
| графит
|
| |
| NaNO3
| платина
| 0,85
| 2,5
| 0,5
| графит
|
| |
| CuCl2
| графитовые
| 0.75
|
|
| медные
|
| |
| KNO3
| графитовые
| 0.7
|
| 2,5
| платина
|
| |
| LiNO3
| графитовые
| 0,65
|
| 0,5
| никелевые
|
| |
| ZnSO4
| цинковые
| 0,9
|
|
| платина
|
| |
| FeCl3
| графитовые
| 0,85
| 0,6
| 0,5
| цинк
|
| |
| K2SO4
| графитовые
| 0,9
|
| 0,2
| платина
|
| |
| NaCl
| графитовые
| 0,75
|
| 3,5
| никелевые
|
| |
| Cu(NO3)2
| графитовые
| 0,9
|
| 0,4
| медные
|
| |
| AgNO3
| графитовые
| 0,65
|
|
| цинковые
|
| |
| CoCl2
| графитовые
| 0,9
|
|
| медные
|
| |
| BaCl2
| графитовые
| 0,85
|
| 0,5
| цинковые
|
| |
| NaCl
| графитовые
| 0,85
|
| 0,5
| цинковые
|
| |
| NaNO3
| графитовые
| 0,85
|
| 0,5
| цинковые
|
| |
| AgNO3
| графитовые
| 0,85
|
| 0,5
| цинковые
|
| |
| KCl
| графитовые
| 0,85
|
| 0,5
| цинковые
|
| |
| CuCl2
| графитовые
| 0,85
|
| 0,5
| цинковые
|
| |
| SnCl2
| графитовые
| 0,9
| 2,5
| 0,5
| цинковые
|
| |
| CoSO4
| графитовые
| 0,7
|
|
| цинковые
|
|
Таблица 4
| Номер варианта
| Пары металлов
| рН
| |
| Pb-Sn
|
| |
| Sn-Cu
|
| |
| Fe-Co
|
| |
| Cu-Co
|
| |
| Fe-Ni
|
| |
| Sn-Cd
|
| |
| Cd-Cu
|
| |
| Zn-Ag
|
| |
| Cd-Pb
|
| |
| Fe-Cu
|
| |
| Fe-Pb
|
| |
| Sn-Ag
|
| |
| Zn-Ni
|
| |
| Ni-Sn
|
| |
| Zn-Sn
|
| |
| Zn-Cd
|
| |
| Fe-Cu
|
| |
| Sn-Cu
|
| |
| Pb-Cu
|
| |
| Cd-Cu
|
| |
| Sn-Cd
|
| |
| Zn-Cu
|
| |
| Zn-Ag
|
| |
| Cu-Co
|
| |
| Fe-Co
|
|
Таблица 5
| Номер варианта
| Схема окислительно-восстановительной реакции
| Концентрации
(в моль/л)
| |
| 2Cl- + 2Fe3+ = 2Fe2+ + Cl2
| -
| |
| 2 Hg + 2 Ag+ = 2Ag + Hg22+
| [Ag+]=10-1, [Hg22+]=10-4
| |
| 2Fe3+ + Hg = 2Fe2+ + Hg2+
| [Fe2+]=10-1, [Fe3+]=10-3 [Hg2+]=10-4
| |
| Hg2+ + 2Fe2+ = Hg + 2Fe3+
| [Fe2+]=10-1, [Fe3+]=10-3 [Hg2+]=10-4
| |
| SnCl4 + 2 KJ = SnCl2 + J2 + 2 KCl
| -
| |
| 2 KBr + PbO2 + 4 HNO3 = Pb(NO3)2 + Br2 + 2KNO3 + 2 H2O
| -
| |
| Hg2+2 + 2Fe2+ = 2Hg + 2Fe3+
| [Fe2+]=10-1, [Fe3+]=10-3 [Hg2+2]=10-4
| |
| MnO4- + Ag = MnO42- + Ag+
| -
| |
| SnCl4 + H2S = SnCl2 + S + 2 HCl
| -
| |
| 2 Hg + 2 Ag+ = 2Ag + Hg22+
| [Ag+]=10-3, [Hg22+]=10-2
| |
| 2Fe3+ + Hg = 2Fe2+ + Hg2+
| [Fe2+]=10-3, [Fe3+]=10-2 [Hg2+]=10-2
| |
| SnCl4 + 2 KJ = SnCl2 + J2 + 2 KCl
| [Sn4+]=10-3, [Sn2+]=10-1
| |
| MnO4- + Ag = MnO42- + Ag+
| [Ag+]=10-4
| |
| Hg2+2 + 2Fe2+ = 2Hg + 2Fe3+
| [Fe2+]=10-3, [Fe3+]=10-2 [Hg2+2]=10-1
| |
| Hg2+ + 2Fe2+ = Hg + 2Fe3+
| [Fe2+]=10-3, [Fe3+]=10-2 [Hg2+]=10-2
| |
| MnO4- + Ag = MnO42- + Ag+
| [Ag+]=10-1
| |
| SnCl4 + H2S = SnCl2 + S + 2 HCl
| [Sn4+]=10-3, [Sn2+]=10-1
| |
|
|
| |
| SnCl4 + 2 KJ = SnCl2 + J2 + 2 KCl
| [Sn4+]=10-2, [Sn2+]=10-3
| |
| Hg2+2 + 2Fe2+ = 2Hg + 2Fe3+
| [Fe2+]=10-4, [Fe3+]=10-2 [Hg2+2]=10-3
| |
| 2 Hg + 2 Ag+ = 2Ag + Hg22+
| [Ag+]=10-2, [Hg22+]=10-5
| |
| 2Fe3+ + Hg = 2Fe2+ + Hg2+
| [Fe2+]=10-4, [Fe3+]=10-1 [Hg2+]=10-2
| |
| Hg2+2 + 2Fe2+ = 2Hg + 2Fe3+
| [Fe2+]=10-1, [Fe3+]=10-4 [Hg2+2]=10-1
| |
| Hg2+ + 2Fe2+ = Hg + 2Fe3+
| [Fe2+]=10-4, [Fe3+]=10-1 [Hg2+]=10-2
| |
| SnCl4 + H2S = SnCl2 + S + 2 HCl
| [Sn4+]=10-2, [Sn2+]=10-3
|
Таблица 6. Стандартные окислительно-восстановительные потенциалы при 25 0С
| Полуреакции: Окисл. форма ® Восстановл. форма
| Е0, В
| | F2+ 2 e ® 2F-
| 2,87
| | MnO4+ 8H++ 5 e ® Mn2++ 4 H2O
| 1,52
| | PbO2+ 4H++ 2e ® Pb + 2 H2O
| 1,46
| | ClO3-+ 6H+® Cl-+ 3H2O
| 1,45
| | Au3++ 3e ® Au
| 1,42
| | Cl2+ 2e ® 2 Cl-
| 1,36
| | Cr2O7+ 14H++ 6e-® 2Cr3++ 7 H2O
| 1,35
| | 2NO3-+ 12H++ 10e ® N2+ 6 H2O
| 1,24
| | Pt2++ 2e ® Pt
| 1,20
| | Br2+ 2e ® 2Br-
| 1,07
| | NO3-+ 4H++ 3e ® NO + 2H2O
| 0,96
| | NO3-+ 10H++ 8e ® NH4++ 3H2O
| 0,87
| | Hg2++ 2e ® Hg
| 0,86
| | Ag++ e ® Ag
| 0,80
| | NO3-+ 2H++ e ® NO2+ H2O
| 0,78
| | Fe3++ e ® Fe2+
| 0,77
| | MnO4-+ 2 H2O + 3e ® MnO2+ 4OH-
| 0,57
| | MnO4-+ e ® MnO42-
| 0,54
| | I2+ 2e ® 2I-
| 0,54
| | Cu++ e ® Cu
| 0,52
| | Cu2++ 2e ® Cu
| 0,34
| | Bi3++ 3 e ® Bi
| 0,23
| | SO42-+ 4H++ 2e ® SO2+ 2H2O
| 0,20
| | SO42-+ 8H++ 8e ® S2-+ 4 H2O
| 0,15
| | 2H++ 2e ® 2H2
|
| | Pb2++ 2e ® Pb0
| -0,13
| | Sn2++ 2e ® Sn
| -0,14
| | Ni2++ 2e ® Ni
| -0,25
| | Co2++ 2e ® Co
| -0,28
| | Cd2++ 2e ® Cd
| -0,40
| | Fe2++ 2e ® Fe
| -0,44
| | S + 2e ® S2-
| -0,45
| | Cr3++ 3e ® Cr0
| -0,71
| | Zn2++ 2e ® Zn
| -0,76
| | Mn2++ 2e ® Mn
| -1,05
| | Al3++ 3e ® Al
| -1,67
| | Mg2++ 2e ® Mg
| -2,34
| | Na++ e ® Na
| -2,71
| | Ca2++ 2e ® Ca
| -2,87
| | Sr2++ 2e ® Sr
| -2,89
| | Ba2++ 2e ® Ba
| -2,90
| | K++ e ® K
| -2,92
| | Rb++ e ® Rb
| -2,99
| | Li++ e ® Li
| -3,02
|
Библиографический список
| | 1. Основная
| |
| Глинка, Н.Л. Общая химия / Н.Л. Глинка; под ред. А.И.Ермакова.-Изд.30-е,испр.. М. : Интеграл-Пресс, 2006 . - 727 с. : ил.
| |
| Глинка, Н.Л. Задачи и упражнения по общей химии : учеб. Пособие для нехим. специальностей вузов/ Н.Л. Глинка, под ред. В.А. Рабиновича, Х.М. Рубиной.-Изд. стер..-М.: Интеграл-Пресс, 2006.-240 с.
| | | 2. Методическая
| |
| Шпагина, И.Н. Общая химия. Окислительно-восстановительные процессы/ И.Н. Шпагина, В.А. Шорин.-Вологда: ВоПИ, 1981.-53 с.
| | | 3. Дополнительная
| |
| Зайцев, О.С. Задачи и вопросы по химии / О.С. Зайцев. - М.: Химия, 1985.-304 с., ил.
| |
| Задачи и упражнения по общей химии / Б.И. Адамсон, О.Н. Гончарук, В.Н. Камышова и др.; под ред. Н.В. Коровина.-2-е изд., испр.-М.: Высш. шк., 2004.-255 с., ил.
| |
| Дамаскин, Б.Б. Основы теоретической электрохимии / Б.Б. Дамаскин, О.А. Петрий -М.: Высш. шк., 1978.- 239 с., ил.
| |
| Задачи и упражнения по общей химии: учеб. пособие для вузов по техн. специальностям / под ред. Н.В. Коровина. - Изд.2-е, испр..- М.: Высш. шк., 2004.- 255 с.
|
Не нашли, что искали? Воспользуйтесь поиском по сайту:
©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|


 , тогда m =
, тогда m =  , где М- молярная масса вещества, а n – число электронов, перемещаемых при окислении или восстановлении
, где М- молярная масса вещества, а n – число электронов, перемещаемых при окислении или восстановлении 100 . Так как m = Kэ I t или m =
100 . Так как m = Kэ I t или m =  100%
100%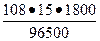 = 30,2(г), так как Вт = 0,85,
= 30,2(г), так как Вт = 0,85, I t =
I t =  = 1,56(л), так как Вт = 0,85,
= 1,56(л), так как Вт = 0,85,