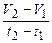|
|
Методы защиты от коррозии12 Проблема защиты металлов от коррозии возникла почти в самом начале их использования. Люди пытались защитить металлы от атмосферного воздействия с помощью жира, масел, а позднее и покрытием другими металлами и, прежде всего, легкоплавким оловом. Задачей химиков было и остается выяснение сущности явлений коррозии, разработка мер, препятствующих или замедляющих её протекание. Коррозия металлов осуществляется в соответствии с законами природы и поэтому ее нельзя полностью устранить, а можно лишь замедлить. В зависимости от характера коррозии и условий ее протекания применяются различные методы защиты. Выбор того или иного способа определяется его эффективностью в данном конкретном случае, а также экономической целесообразностью. Легирование Имеется способ уменьшения коррозии металлов, который строго нельзя отнести к защите. Этим способом является получение сплавов, которое называется легирование. В настоящее время создано большое число нержавеющих сталей путем присадок к железу никеля, хрома, кобальта и др. Такие стали, действительно, не покрываются ржавчиной, но их поверхностная коррозия имеет место, хотя и с малой скоростью. Защитные пленки Одним из наиболее распространенных способов защиты металлов от коррозии является нанесение на их поверхность защитных пленок: лака, краски, эмали, других металлов. Лакокрасочные покрытия наиболее доступны для широкого круга людей. Лаки и краски обладают низкой газо- и паропроницаемостью, водоотталкивающими свойствами, поэтому они препятствуют доступу к поверхности металла воды, кислорода и содержащихся в атмосфере агрессивных компонентов. Покрытие поверхности металла лакокрасочным слоем не исключает коррозию, а служит для нее лишь преградой, а значит, лишь тормозит процесс коррозии. Грунтовки и фосфатирование Часто под лакокрасочный слой наносят грунтовки. Пигменты, входящие в ее состав, также должны обладать ингибиторными свойствами. Проходя через слой грунтовки, вода растворяет некоторое количество пигмента и становится менее коррозионноактивной. Среди пигментов, рекомендуемых для грунтов, наиболее эффективным признан свинцовый сурик Pb3O4. Вместо грунтовки иногда проводят фосфатирование поверхности металла. Для этого на чистую поверхность кистью или распылителем наносят растворы ортофосфатов железа (III), марганца (II) или цинка (II), содержащих и саму ортофосфорную кислоту H3PO4. В образование фосфатного покрытия вносят вклад металл, растворяющийся в фосфатирующейся смеси, и оставшиеся на его поверхности оксиды. Пленка фосфатов защищает поверхность изделия от атмосферных осадков, но мало эффективна от растворов солей и даже слабых растворов кислот. Таким образом, фосфатная пленка может служить лишь грунтом для последовательного нанесения органических защитных и декоративных покрытий – лаков, красок, смол. Электрохимическая защита В производственных условиях используют также электрохимический способ – обработку изделий переменным током в растворе фосфата цинка при плотности тока 4 А/дм2 и напряжении 20 В и при температуре 60-70 оC. Фосфатные покрытия представляют собой сетку плотносцепленных с поверхностью фосфатов металлов. Сами по себе фосфатные покрытия не обеспечивают надежной коррозионной защиты. Преимущественно их используют как основу под окраску, обеспечивающую хорошее сцепление краски с металлом. Кроме того, фосфатный слой уменьшает коррозионные разрушения при образовании царапин или других дефектов. Силикатные покрытия Для защиты металлов от коррозии используют стекловидные и фарфоровые эмали, коэффициент теплового расширения которых должен быть близок к таковому для покрываемых металлов. Эмалирование осуществляют нанесением на поверхность изделий водной суспензии или сухим напудриванием. Кроме того, вводят вспомогательные материалы: окислители органических примесей, оксиды, способствующие сцеплению эмали с эмалируемой поверхностью, глушители, красители. Эмали обладают высокими защитными свойствами, которые обусловлены их непроницаемостью для воды и воздуха (газов) даже при длительном контакте. Их важным качеством является высокая стойкость при повышенных температурах. К основным недостаткам эмалевых покрытий относят чувствительность к механическим и термическим ударам. При длительной эксплуатации на поверхности эмалевых покрытий может появиться сетка трещин, которая обеспечивает доступ влаги и воздуха к металлу, вследствие чего и начинается коррозия. Цементные покрытия Для защиты чугунных и стальных водяных труб от коррозии используют цементные покрытия. Поскольку коэффициенты теплового расширения портландцемента и стали близки, то он довольно широко применяется для этих целей. Недостаток портландцементных покрытий тот же, что и эмалевых, – высокая чувствительность к механическим ударам. Покрытие металлами Широко распространенным способом защиты металлов от коррозии является покрытие их слоем других металлов. Покрывающие металлы сами корродируют с малой скоростью, так как покрываются плотной оксидной пленкой. Покрывающий слой наносят различными методами: · горячее покрытие – кратковременное погружение в ванну с расплавленным металлом; · гальваническое покрытие – электроосаждение из водных растворов электролитов; · металлизация – напыление; · диффузионное покрытие – обработка порошками при повышенной температуре в специальном барабане; Металлические покрытия защищают железо от коррозии при сохранении сплошности. При нарушении же покрывающего слоя коррозия изделия протекает даже более интенсивно, чем без покрытия. Это объясняется работой гальванического элемента железо–металл. Трещины и царапины заполняются влагой, в результате чего образуются растворы, ионные процессы в которых облегчают протекание электрохимического процесса (коррозии). Ингибиторы Применение ингибиторов – один из самых эффективных способов борьбы с коррозией металлов в различных агрессивных средах. Ингибиторы – это вещества, способные в малых количествах замедлять протекание химических процессов или останавливать их. Ингибирующее воздействие на металлы, прежде всего на сталь, оказывает целый ряд неорганических и органических веществ, которые часто добавляются в среду, вызывающую коррозию. Ингибиторы имеют свойство создавать на поверхности металла очень тонкую пленку, защищающую металл от коррозии. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ Приготовление растворов. В ходе данной лабораторной работы используют уже приготовленные растворы с различной концентрацией HCl. Концентрацию рабочего раствора задаёт преподаватель. Подготовка образцов стали. В качестве исследуемого образца используют пластинки цинка различной чистоты или пластинки другого металла. Перед опытом измеряют её площадь и массу (S, см2; m0, г). Методика эксперимента
Пластинку, подготовленную согласно пункту 2.2. подвешивают на крючок в водородном коррозиметре. Бюретка помещается в химический стакан с раствором кислоты и с помощью резиновой груши заполняется этим раствором. После того как вся установка собрана, отмечают время по секундомеру и соответствующее этому начальному моменту времени положение мениска жидкости в верхней части бюретки. В последующем отсчеты объемов производят через каждые 2 минуты в течение 25-30 минут. Полученные данные представляют в таблице 1 и отображают на графике «объём выделенного водорода-время». Если процесс протекает с постоянной скоростью, то объем выделенного водорода прямо пропорционален времени. Наклон прямой дает непосредственное значение скорости коррозии металла в растворе кислоты.
iкор.= tgα = Рис.1. Водородный коррозиметр
Величину этой скорости следует выразить с помощью весового показателя скорости коррозии в мм/см2•мин, принимая во внимание размер образца. На основе данных таблицы1, расчёт скорости коррозии производится исходя из объёма газа, собранного в бюретке за всё время опыта, что даёт среднее значение скорости коррозии. Скорость коррозии можно определить и по потери массы металлической пластинки. Для этого после опыта её тщательно высушивают, взвешивают(m) и выражают скорость коррозии в г/см2•час. Одной из возможных причин погрешности в оценке скорости коррозии в данном методе служит прилипание пузырьков водорода к стенкам бюретки. Чтобы избежать этого перед опытом необходимо тщательно промыть водородный коррозиметр хромовой смесью, тщательно ополаснуть сначала водопроводной, а затем дистиллированной водой, добиваясь полной смачиваемости внутренних стенок бюретки.
Таблица 1 Зависимость объёма выделившегося водорода от времени при коррозии цинка в 1 н HCl
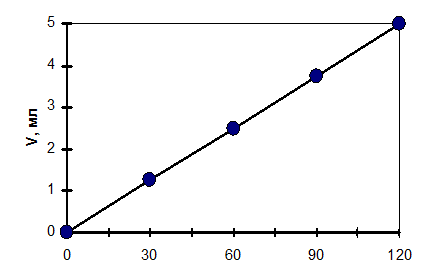
Строят график V=f(τ) и расчитывают скорость коррозии.
КОНТРОЛЬНЫЕ ВОПРОСЫ
ПРИМЕР РАСЧЁТОВ
Таблица 1 Зависимость объёма выделившегося водорода от времени при коррозии цинка в 1 н HCl
1) i = 1,25/0,5 = 2,5 мг/(см2час) - скорость коррозии в 1 н HCl
Рис. Зависимость V выделившегося водорода от τ при коррозии цинка в 1 н HCl

12 Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 Для проведения эксперимента по определению скорости коррозии цинка (или другого металла) собирают установку (рис. 1) – водородный коррозиометр. Он состоит из газовой бюретки, снабженной в нижней части расширением, внутри которого крючок для закрепления образца.
Для проведения эксперимента по определению скорости коррозии цинка (или другого металла) собирают установку (рис. 1) – водородный коррозиометр. Он состоит из газовой бюретки, снабженной в нижней части расширением, внутри которого крючок для закрепления образца.