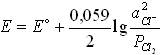|
|
Фазовое и химическое равновесие№1. Реакции в идеальной газовой фазе, равновесие которых при уменьшении общего давления смещается влево (в сторону исходных веществ): 1) 2NO2 = 2NO + O2; 2) N2 + 3H2 = 2NH3; 3) H2 + I2(г) = 2HI(г); 4) 2SO2 + O2 = 2SO3; 5) CO + H2O(г) = CO2 + H2; 6) CH4 + H2O(г) = CO + 3H2; 7) CH4 + CO2 = 2CO + 2H2.
№2. Реакции в идеальной газовой фазе, равновесие которых при уменьшении общего давления смещается вправо (в сторону продуктов): 1) 2NO2 = 2NO + O2; 2) N2 + 3H2 = 2NH3; 3) H2 + I2(г) = 2HI(г); 4) 2SO2 + O2 = 2SO3; 5) CO + H2O(г) = CO2 + H2; 6) CH4 + H2O(г) = CO + 3H2; 7) CH4 + CO2 = 2CO + 2H2.
№3. Реакции в идеальной газовой фазе, на равновесие которых не влияет изменение общего давления: 1) 2NO2 = 2NO + O2; 2) N2 + 3H2 = 2NH3; 3) H2 + I2(г) = 2HI(г); 4) 2SO2 + O2 = 2SO3; 5) CO + H2O(г) = CO2 + H2; 6) CH4 + H2O(г) = CO + 3H2; 7) CH4 + CO2 = 2CO + 2H2.
№4. Реакции в идеальной газовой фазе, для которых константы равновесия, выраженные через равновесные парциальные давления, мольные доли или молярные концентрации численно совпадают: 1) 2NO2 = 2NO + O2; 2) N2 + 3H2 = 2NH3; 3) H2 + I2(г) = 2HI(г); 4) 2SO2 + O2 = 2SO3; 5) CO + H2O(г) = CO2 + H2; 6) CH4 + H2O(г) = CO + 3H2; 7) CH4 + CO2 = 2CO + 2H2.
5.Уравнения, справедливые для констант равновесия, выраженных через равновесные парциальные давления (P), мольные доли (x) или молярные концентрации (c), для химических реакций в идеальной газовой фазе:
5)
№6. Уравнение Клапейрона-Клаузиуса описывает зависимость равновесного давления от температуры для: 1) однокомпонентной однофазной системы; 2) однокомпонентной двухфазной системы; 3) двухкомпонентной однофазной системы; 4) двухкомпонентной двухфазной системы; 5) двухкомпонентной трехфазной системы.
№7. На диаграмме состояния чистого вещества имеются точки: 1) эвтектики; 2) азеотропа; 3) тройная точка; 4) точка кипения; 5) точка перитектики.
№8. Взаимные переходы кристаллических модификаций чистого вещества, которые могут протекать как в прямом, так и в обратном направлениях в условиях равновесия: 1) монотропные; 2) энантиотропные; 3) необратимые; 4) обратимые.
№9. Находящаяся в состоянии равновесия система 2SO2(г) + О2(г) = 2SO3(г): 1) гомогенная; 2) гетерогенная; 3) однофазная; 4) двухфазная; 5) трехфазная; 6) четырехфазная.
№10. Число степеней свободы (вариантность состояния) системы, состоящей из К компонентов и Ф фаз, на которую из внешних условий влияют только давление и температура
№11. Число степеней свободы (вариантность состояния) системы, состоящей из К компонентов и Ф фаз, на которую из внешних условий влияет только температура (давление постоянно):
№12. Диаграмма состояния воды при невысоких давлениях:
Выберите номер области существования жидкости на фазовой диаграмме воды. №13. Линии ликвидус на диаграмме плавкости системы AB:
1) CM и DK; 2) ТАC и ТBD; 3) ТАЕ и ТBЕ; 4) ТАЕ и ТAC; 5) ТBЕ и ТBD.
№14. Фазовая диаграмма двухкомпонентной системы с одним химическим соединением АхВу, плавящимся конгруэнтно:
В эвтектическом равновесии, представленном коннодой DЕ2D’ сосуществуют фазы: 1) кристаллы А, кристаллы В и жидкость; 2) кристаллы А, кристаллы В и кристаллы АхВу ; 3) кристаллы А, кристаллы АхВу и жидкость; 4) кристаллы B, кристаллы АхВу и жидкость; 5) кристаллы А и кристаллы АхВу; 6) кристаллы B и кристаллы АхВу; 7) только кристаллы А; 8) только кристаллы В; 9) только кристаллы АхВу.
№15. На диаграмме состояния для чистого вещества имеются линии 1) для равновесия жидкость-пар; 2) для равновесия трех фаз; 3) для равновесия двух газообразных фаз; 4) для равновесия кристаллы-пар; 5) для равновесия жидкость-кристаллы.
Растворы №1. Метод исследования разбавленных растворов, основанный на сравнении температуры начала кипения раствора и температуры кипения растворителя при постоянном давлении: 1) калориметрия; 2) криоскопия; 3) осмометрия; 4) тензиметрия; 5) эбуллиоскопия; 6) фотометрия.
№2. Повышение температуры начала кипения разбавленного раствора нелетучего растворенного вещества в летучем растворителе по сравнению с температурой кипения растворителя выражается формулой ΔT = iEm. Буквой m в этой формуле обозначена: 1) масса растворителя; 2) масса растворенного вещества; 3) масса раствора; 4) молярная концентрация растворенного вещества; 5) моляльная концентрация растворенного вещества; 6) число моль растворенного вещества в растворе.
№3. Утверждения, справедливые для эбуллиоскопической константы: 1) зависит только от свойств растворителя; 2) зависит от свойств растворителя и растворенного вещества; 3) зависит от свойств растворителя и концентрации раствора; 4) зависит от температуры и концентрации раствора; 5) увеличивается с ростом соотношения удельной теплоты испарения к квадрату температуры кипения; 6) уменьшается с ростом соотношения удельной теплоты испарения к квадрату температуры кипения.
№4. Изотонический коэффициент Вант-Гоффа это поправка, учитывающая: 1) увеличение равновесного давления пара над чистым растворителем при нагревании; 2) непостоянство давления при нагревании или охлаждении раствора; 3) различие молярных масс растворителя и растворенного вещества; 4) изменение числа частиц в растворе при диссоциации или ассоциации молекул; 5) изменение плотности раствора при диссоциации или ассоциации молекул; 6) изменение изотопного состава молекул растворенного вещества.
№5. Ионная сила раствора выражается через моляльности ионов mi и их заряды zi формулой:
№6. Уменьшение эквивалентной проводимости водного раствора уксусной кислоты при повышении концентрации электролита обусловлено главным образом: 1) электрофоретическим эффектом; 2) релаксационным эффектом; 3) уменьшением вязкости раствора; 4) снижением степени диссоциации; 5) увеличением степени диссоциации; 6) увеличением кинетической энергии ионов.
№7. При бесконечном разведении эквивалентная электропроводность водного раствора электролита равна: 1) нулю; 2) электропроводности воды; 3) сумме предельных подвижностей ионов; 4) разности предельных подвижностей ионов; 5) произведению предельных подвижностей ионов.
№8. Эквивалентная электропроводность водного раствора электролита максимальна: 1) в его насыщенном растворе; 2) в его пересыщенном растворе; 3) при бесконечном разведении; 4) в его разбавленном растворе; 5) в его концентрированном растворе.
№9. С увеличением концентрации растворённого вещества температура кристаллизации раствора: 1) убывает; 2) растет пропорционально квадрату концентрации; 3) не меняется; 4) убывает по экспоненциальному закону; 5) растет по экспоненциальному закону.
№10. Для расчёта криоскопической постоянной необходимо знать: 1) мольную массу растворенного вещества; 2) мольную массу растворителя; 3) универсальную газовую постоянную; 4) температуру кристаллизации чистого растворителя; 5) постоянную Планка.
№11. Азеотропный раствор – это раствор: 1) пар над которым имеет тот же состав, что и жидкость; 2) пар над которым более обогащен легколетучим компонентом; 3) имеющий самую большую мольную массу; 4) нелетучего вещества; 5) соответствующий точке эвтектики.
№12. Для измерения электропроводности растворов используется: 1) мост постоянного тока; 2) мост переменного тока; 3) мост Кольрауша; 4) потенциометр; 5) потенциостат.
№13. Резкое падение электропроводности раствора при нейтрализации щёлочью связано: 1) с уменьшением суммарной концентрации ионов; 2) с уменьшением концентрации очень подвижных ионов гидроксония; 3) с накоплением в системе ионов гидроксила; 4) с образованием осадка; 5) с разбавлением раствора.
№14. Буферный раствор это: 1) раствор соли сильного основания и слабой кислоты и соответствующего основания; 2) раствор сильной кислоты и слабого основания; 3) раствор, способный поддерживать постоянство состава при добавлении к нему других веществ; 4) раствор, способный поддерживать постоянство pH при добавлении небольших количеств кислоты или основания.
№15. Температура кристаллизации линейно зависит от концентрации второго компонента: 1) для концентрированных идеальных растворов; 2) для концентрированных реальных растворов; 3) для идеальных разбавленных растворов; 4) для неидеальных растворов; 5) для совершенных растворов.
Электрохимия №1. Известны следующие методы измерения ЭДС гальванического элемента: 1) потенциометрический; 2) полярографический; 3) метод вольтметра с высоким внутренним сопротивлением; 4) компенсационный; 5) кондукторометрический.
№2. Для нормально разомкнутого гальванического элемента электродвижущая сила равна: 1) разности электродных потенциалов на выводах ГЭ; 2) падению напряжения на внешнем участке цепи с гальваническим элементом; 3) напряжению на выводах работающего элемента; 4) произведению тока на сумму сопротивлений; 5) полусумме произведений квадратов зарядов частиц на концентрацию.
№3. Величину гальванического элемента можно рассчитать: 1) с помощью уравнения Фарадея; 2) с помощью уравнения Фрумкина; 3) с помощью уравнения Нернста; 4) с помощью уравнения Гиббса-Дюгема; 5) как разность условных электродных потенциалов.
№4. Для расчёта ЭДС с помощью уравнения Нернста необходимо знать: 1) стандартную ЭДС элемента и температуру; 2) ЭДС нормального элемента Вестона; 3) стехиометрическое уравнение реакции в элементе; 4) электропроводность растворов, входящих в состав элемента; 5) атмосферное давление.
№5. Электрод, стандартный электродный потенциал которого при 298К в водном растворе принят равным нулю: 1) платиновый; 2) серебряный; 3) хлорсеребряный; 4) каломельный; 5) кислородный в растворе кислоты; 6) кислородный в растворе щёлочи; 7) водородный в растворе кислоты; 8) водородный в растворе щёлочи.
№6. Химический гальванический элемент с двумя электродами первого рода: 1) Cu|Zn|ZnCl2(р-р)||CuCl2(р-р)|Cu; 2) Zn|ZnCl2(р-р)||ZnCl2(р-р)|Zn; 3) Ag|Zn|ZnCl2(р-р)||KCl(р-р)|AgCl(тв)|Ag; 4) Ag|AgCl(тв)|KCl(р-р)||KCl(р-р)|AgCl(тв)|Ag; 5) Pt|Ag|AgCl (тв)|KCl(р-р)|Cl2, Pt; 6) Ag|Zn|ZnCl2(р-р)|AgCl(тв)|Ag;
№7. Концентрационным называется гальванический элемент, у которого: 1) величина ЭДС определяется изменением энергии Гиббса в самопроизвольной химической реакции; 2) величина ЭДС определяется изменением энергии Гиббса в самопроизвольной химической реакции и не зависит от концентрации реагентов и продуктов; 3) величина ЭДС определяется изменением энергии Гиббса в самопроизвольной химической реакции и зависит от концентрации реагентов и продуктов; 4) электроды содержат одни и те же фазы, величина ЭДС определяется отношением активности веществ или ионов; 5) величина ЭДС определяется только разностью температур электродов.
№8. Уравнение Нернста для потенциала хлорного электрода (E) при небольших давлениях газообразного хлора (P(Cl2), атм):
6)
№9. Выберите гальванический элемент, по измерениям стандартной ЭДС которого возможно определить константу равновесия реакции 2Ag + Cl2 = 2AgCl: 1) Cu|Zn|ZnCl2(р-р)||CuCl2(р-р)|Cu; 2) Zn|ZnCl2(р-р)||ZnCl2(р-р)|Zn; 3) Ag|Zn|ZnCl2(р-р)||KCl(р-р)|AgCl(тв)|Ag; 4) Ag|AgCl(тв)|KCl(р-р)||KCl(р-р)|AgCl(тв)|Ag; 5) Pt|Ag|AgCl (тв)|KCl(р-р)|Cl2, Pt; 6) Ag|Zn|ZnCl2(р-р)|AgCl(тв)|Ag.
№10. Электродный потенциал цинкового электрода в стандартных условиях в водном растворе при температуре 298К равен –0,763 В. Из данного электрода и стандартного водородного электрода в растворе кислоты при 298 К составлен гальванический элемент, в котором отсутствует диффузионная разность потенциалов. Выберите все справедливые утверждения, описывающие этот элемент. 1) цинковый электрод образует положительный полюс гальванического элемента; 2) цинковый электрод образует отрицательный полюс гальванического элемента; 3) в цинковом электроде самопроизвольно протекает реакция восстановления; 4) в цинковом электроде самопроизвольно протекает реакция окисления; 5) в названном гальваническом элементе самопроизвольная химическая реакция не протекает; 6) названный гальванический элемент является химическим; 7) названный гальванический элемент является концентрационным; 8) ЭДС названного гальванического элемента равна 0,763 В; 9) ЭДС названного гальванического элемента равна –0,763 В; 10) ЭДС названного гальванического элемента по условию задачи определить невозможно.
№11. Число Z, входящее в уравнение Нернста соответствует: 1) числу электронов, участвующих в реакции; 2) числу электродных реакций; 3) зарядовому числу анионов в растворе; 4) зарядовому числу ионов гидроксония; 5) произведению зарядовых чисел катионов и анионов.
№12. Используемый в хингидронном электроде хингидрон представляет собой: 1) эквимолекулярное соединение хинона и гидроксиламина; 2) легко растворимая смесь хинона и гидроокиси хрома; 3) малорастворимое соединение; 4) малорастворимое соединение хинона со следами гидрохинона; 5) эквимолекулярное соединение хинона и гидрохинона.
№13. Каломельный электрод относится к: 1) окислительно-восстановительным; 2) электродам 1 рода; 3) электродам 2 рода; 4) электродам сравнения; 5) ионообменным электродам.
№14. Электролитический ключ, служащий для элиминирования диффузионного потенциала: 1) заполнен дистиллированной водой; 2) содержит ионы с одинаковой подвижностью; 3) содержит ионы в аномальной подвижностью; 4) заполнен исследуемым раствором; 5) содержит раствор хлористого калия.
№15. Металл, используемый в газовых электродах должен: 1) участвовать в электродной реакции; 2) быть инертным к электродной реакции; 3) хорошо сорбировать газы; 4) полностью исключать сорбцию газов; 5) иметь сильно развитую поверхность.
Кинетика и катализ №1. Уравнение, соответствующее реакции первого порядка: 1) υ = кС2(А)С(В); 2) υ = кС2(А); 3) υ = кС(А)С(В); 4) υ = кС(А)С2(В).
№2. Стадия, определяющая скорость реакции: 1) медленной стадией; 2) быстрой стадией; 3) разностью скоростей всех стадий; 4) суммой скоростей всех стадий.
№3. На активность катализатора влияет: 1) наличие активных адсорбционных центров; 2) химический состав; 3) достаточно развитая поверхность; 4) характер пористости катализатора.
№4. При каталитических процессах изменяется: 1) скорость реакции; 2) состояние равновесия в реакционной системе; 3) предел протекания реакции; 4) энергия активации.
№5. Каталитическая активность имеет место, когда: 1) атомы или ионы катализатора частично связываются с молекулами реагирующих веществ; 2) расположение атомов или ионов катализатора находится в пространственном соответствии с расположением атомов в молекулах реагирующих веществ; 3) происходит частичное ослабление связей в молекулах реагирующих веществ; 4) происходит деформация связей в реагирующих молекулах.
№6. Гетерогенными каталитическими реакциями называю такие, у которых: 1) реагирующие вещества находятся в различных фазах; 2) реагирующие вещества и продукты реакции находятся в различных фазах; 3) катализатор составляет самостоятельную фазу; 4) катализатор и продукты реакции находятся в различных фазах.
№7. Радикальными реакциями являются: 1) получение HCl из Cl2 и H2; 2) образование воды из H2 и O2 ; 3) образование HI из H2 и I2; 4) окисление углеводородов.
№8. Под специфичностью катализатора понимают: 1) способность катализатора увеличивать скорость реакций, для которых одно из реагирующих веществ является общим; 2) способность катализатора влиять только на одну из реакций при наличии нескольких параллельных реакций; 3) способность катализатора изменять скорость реакции только для одного из изомеров; 4) способность катализатора увеличивать скорость реакции только между определённой парой реагирующих веществ.
№9. Значение констант скорости реакции зависит: 1) от температуры; 2) от концентрации реагентов; 3) от вида растворителя; 4) от концентрации продуктов; 5) от давления.
№10. Константа скорости реакции при увеличении температуры: 1) возрастает по экспоненциальному закону; 2) убывает по экспоненциальному закону; 3) возрастает в соответствии с уравнением Аррениуса; 4) убывает с ростом температуры; 5) растет пропорционально квадрату температуры.
№11. Размерность константы скорости реакции первого порядка: 1) м/с. 2) 1/с. 3) м3/(моль×с). 4) м6/(моль2×с). 5) с/м.
№12. Выберите заключения, справедливые для реакции в растворе, в случае, когда молекулы исходных веществ сольватированы, а переходное состояние не сольватировано: 1) сольватация молекул исходных веществ уменьшает энергию активации; 2) сольватация молекул исходных веществ увеличивает энергию активации; 3) сольватация молекул исходных веществ сводит энергию активации к нулю; 4) сольватация молекул исходных веществ делает энергию активации отрицательной; 5) сольватация молекул исходных веществ делает реакцию невозможной.
№13. Порядком реакции называется: 1) количество различных видов частиц исходных веществ; 2) количество различных видов частиц исходных веществ и продуктов; 3) количество частиц исходных веществ, взаимодействующих в одном элементарном акте превращения; 4) количество частиц, взаимодействующих и образующихся в одном элементарном акте превращения; 5) показатель степени при концентрации в дифференциальной форме кинетического уравнения; 6) показатель степени при концентрации в интегральной форме кинетического уравнения.
№14. Молекулярностью реакции называется: 1) количество различных видов частиц исходных веществ; 2) количество различных видов частиц исходных веществ и продуктов; 3) количество частиц исходных веществ, взаимодействующих в одном элементарном акте превращения; 4) количество частиц, взаимодействующих и образующихся в одном элементарном акте превращения; 5) показатель степени при концентрации в дифференциальной форме кинетического уравнения; 6) показатель степени при концентрации в интегральной форме кинетического уравнения.
№15. В совокупности стадий неразветвленной цепной реакции образования фосгена (CO + Cl2 = COCl2) выберите стадии развития цепи 1) Cl2 + M ® 2Cl• + M; 2) Cl• + X(стенка) ® XCl(стенка); 3) 2Cl• + M ® Cl2 + M; 4) Cl• + CO + M ® COCl• + M; 5) COCl• ® Cl• + CO; 6) COCl• + Cl2 ®COCl2 + Cl•.
Вопросы для подготовки к экзамену 1. Первый закон термодинамики, математическое выражение его для изолированной, закрытой, адиабатной и открытой системы. 2. Общая характеристика электрохимических процессов и систем. Гальванический элемент, химический и концентрационный. Возникновение электродного потенциала. Уравнение Нернста. 3. Первый закон термодинамики. Функции состояния, их признаки. Внутренняя энергия. Энтальпия. Работа и теплота. 4. Растворы. Термодинамические и молекулярно-кинетические условия образования растворов. Классификация растворов по агрегатному состоянию, размеру частиц, способности к диссоциации. Особенности газообразных, жидких и твёрдых растворов. Природные растворы. 5. Теория теплоёмкости газов и твёрдых веществ. Теплоёмкость при постоянном давлении и объёме. 6. Термодинамическая классификация растворов. Идеальные растворы. Законы Вант-Гоффа и Рауля. Закон Генри и вытекающие из него следствия. 7. Основные положения электролитической диссоциации Аррениуса. Причины и механизм электролитической диссоциации. Сольватация ионов. Энергия сольватации. Недостатки теории Аррениуса и её развитие в работах Д. Бренстеда, Т. Лоури, Н.А. Измайлова. 8. Гетерогенный катализ. Теории гетерогенного катализа А.А. Баландина и Н. И. Кобозева. 9. Второй закон термодинамики. Обратимые и необратимые, самопроизвольные и не самопроизвольные процессы. Изменение энтропии при изменении V системы, Т, числа частиц при фазовых превращениях. 10. Реальные растворы. Растворы с положительными и отрицательными отклонениями от закона Рауля. Причины отклонений. 11. Энтропия как функция состояния. Доказательство существования энтропии. Уравнение Больцмана. Энтропия α- и β-. 12. Кинетическая классификация химических реакций. Кинетические уравнения сложных химических реакций. Молекулярность и порядок реакции. 13. Третий и нулевой законы термодинамики, их значение. 14. Зависимость скорости химической реакции от температуры. Уравнение Аррениуса. Энергия активации. Энтальпия и энтропия активации. 15. Электрохимическая коррозия металлов и методы защиты от неё. Ингибиторы коррозии. Пассивность металлов. 16. Фотохимические и радиационно-химические реакции. Закон эквивалентности. Квантовый выход. Значение фотохимических и радиационно-химических реакций в природе и химической промышленности. 17. Растворы электролитов. Основные положения теории сильных электролитов Дебая-Хюккеля. Термодинамическая константа диссоциации. 18. Цепные реакции. Классификация элементарных стадий. Ингибиторы цепных реакций. Разветвлённые и неразветвлённые цепные реакции. 19. Основные термодинамические функции. Термодинамические потенциалы, их физический смысл, применение. Условия самопроизвольного протекания процессов и достижения равновесия. 20. Сложные реакции. Кинетические закономерности последовательных реакций, слагающиеся из реакций первого порядка. Автокаталитические и самотормозящиеся реакции. 21. Теория электрической проводимости растворов Дебая-Онзагера. Электрофоретический и релаксационный эффекты. Ионная атмосфера, время релаксации ионного облака. 22. Методы определения порядка и константы скорости реакции по экспериментальным данным. 23. Константа химического равновесия. Способы выражения и зависимость от температуры. Уравнение изобары и изохоры химической реакции. 24. Электрохимическая кинетика. Законы Фарадея. Выход вещества по току. 25. Фазовое равновесие. Условия равновесия между фазами. Критические фазы. Характеристика агрегатных состояний вещества. Правило фаз Гиббса, его применение в производстве и для исследования биологических систем. 26. Электрохимические цепи, химические и концентрационные. Измерение ЭДС гальванических элементов. 27. Электрохимический метод определения рН: водородный, хингидронный, стеклянный. 28. Химическое равновесие. Принципы смещения химического равновесия. Уравнение изотермы химической реакции. Энергия Гиббса и Гельмгольца в стандартных условиях, способы их расчёта. 29. Предмет, задачи и методы химической кинетики. Гомогенные и гетерогенные реакции, их скорость. Основной постулат химической кинетики. 30. Теплоёмкость истинная, средняя, молярная, удельная. Зависимость теплоёмкости от температуры. 31. Максимальная работа процесса. Химическое сродство. 32. Приложение I закона термодинамики к химическим процессам. Термохимические уравнения. Закон Гесса и вытекающие из него следствия. Тепловые эффекты химических реакций при постоянном давлении и объёме. Закон Кирхгофа. 33. Энтальпия. Энтальпийные диаграммы. Энтальпия образования, сгорания, растворения, фазовых переходов. Энергия связи, кристаллической решётки, ионизации, гидратации. 34. Химическое равновесие. Термодинамический вывод для константы химического равновесия. Химическое равновесие в гетерогенных реакциях. Различные способы выражения констант равновесия, соотношения между ними. 35. Предмет и роль химической термодинамики в изучении химических и физико-химических процессов. Методы и ограничения термодинамики. 36. Историческая обусловленность возникновения физической химии и других смежных наук. Предмет, задачи и методы физической химии. 37. Двухкомпонентные жидкие и твёрдые системы. Диаграммы состав – температура кристаллизации бинарных неизоморфных смесей с простой эвтектикой и смесей, образующих устойчивое и неустойчивое химическое соединения. Применение фазовых диаграмм в производстве и для исследования биологических систем. 38. Коллигативные свойства разбавленных растворов. Криоскопия и эбуллиоскопия, их применение. Осмос и его роль в биологических процессах. Изотонические растворы. 39. Зависимость температуры кипения и давления пара бинарного раствора от его состава. Законы Коновалова. Азеотропные растворы. Законы Вревского. Методы разделения азеотропных смесей. 40. Химические потенциалы и стандартные состояния компонентов раствора. Парциальные молярные величины. Уравнение Гиббса-Дюгема-Маргулеса. 41. Электрическая проводимость растворов электролитов. Удельная и молярная (эквивалентная) электрические проводимости, зависимость их от различных факторов. Закон Кольрауша. Подвижность ионов и числа переноса. Аномальная подвижность ионов Н+ и ОН–. 42. Молекулярная кинетика. Теория молекулярных столкновений и её применение к биомолекулярным реакциям. 43. Молекулярная кинетика. Теория переходного состояния или активного комплекса. 44. Катализ. Влияние на механизм снижения энергетических барьеров. Селективность. Отравление, промотирование и модифицирование катализаторов. 45. Классификация каталитических процессов. Гомогенный катализ. Кислотно-основной катализ. Автокатализ. 46. Классификация обратимых электродов по типу электродных реакций. Характеристика электродов I и II рода, редокс-электродов. Использование редокс-электродов для определения направления реакции. 47. Гетерогенный катализ. Общая стадийная схема катализа. Электронная и цепная теории катализа. 48. Сложные реакции. Кинетические закономерности обратимых, параллельных и сопряжённых реакций, слагающихся из реакций первого порядка. 49. Поляризация электродов при прохождении электрического тока. Перенапряжение электрохимической реакции и перенапряжение концентрации. Перенапряжение восстановления. 50. Химические источники электрической энергии. Первичные сухие элементы. Элемент Лекланше. Характеристика топливных элементов на примере водородно-кислородного. Аккумуляторы кислотные и щелочные. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|

 3)
3)  2)
2) 
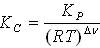 6)
6) 




 4)
4) 
 5)
5)