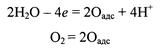|
|
Методы защиты от коррозии
В зависимости от характера коррозии и условий ее протекания применяются различные методы защиты. Любой метод защиты изменяет ход коррозионного процесса, либо уменьшая скорость, либо прекращая его полностью. Эффективность защиты выражают через коэффициент торможения γ или степень защиты Z. Коэффициент торможения показывает: во сколько раз уменьшается скорость коррозии в результате применения данного способа защиты
где ic и ic¢ - скорость коррозии до и после защиты. Степень защиты указывает, насколько полно удалось подавить коррозию благодаря применению этого метода:
или
Катодная защита
Этот метод защиты основан на изменении электрохимических свойств металла под действием поляризующего тока при наложении на него катодной поляризации (катодная защита). При смещении потенциала металла в сторону более электроотрицательных значений (по сравнению с величиной стационарного потенциала коррозии) скорость катодной реакции увеличивается, а скорость анодной падает (см. рис. 4). Если при стационарном потенциале φ соблюдалось равенство
то при более отрицательном значении φ это равенство нарушается:
причем
Рис. 4. Поляризационная диаграмма коррозионного процесса. Уменьшение скорости анодной реакции при катодной поляризации эквивалентно уменьшению скорости коррозии. Внешний ток iвн , необходимый для смещения потенциала до значения φ, представляет собой разницу между катодным и анодным токами iвн= ik ` - ia` (его величина на рис.4 выражена прямой ав). По мере увеличения внешнего тока потенциал смещается в более отрицательную сторону, и скорость коррозии должна непрерывно падать. Когда потенциал корродирующего металла достигает равновесного потенциала анодного процесса аφr , скорость коррозии делается равной нулю (ik = ia=0), коэффициент торможения - бесконечности, а степень защиты 100%. Плотность тока, обеспечивающая полную катодную защиту, называется защитным током i3 . Его величине на рис.4 соответствует отрезок cd. Величина защитного тока не зависит от особенностей протекания данной анодной реакции, в частности от величины сопровождающей ее поляризации, а целиком определяется катодной поляризационной кривой. Так, например, при переходе от водородной деполяризации к кислородной сила защитного тока уменьшается и становится равной предельному диффузному току (отрезок cd на рис.4). Защита металла катодной поляризацией применяется для повышения стойкости металлических сооружений в условиях подземной (почвенной) и морской коррозии, а также при контакте металлов с агрессивными химическими средами. Катодная поляризация защищаемого металла достигается либо наложением тока от внешнего источника (катодная защита), либо созданием макрогальванической пары с менее благородным металлом (обычно применяются алюминий, магний, цинк и их сплавы). Он играет здесь роль анода и растворяется со скоростью, достаточной для создания в системе электрического тока необходимой силы (протекторная защита). Растворимый анод при протекторной защите часто называют "жертвенным анодом". Требуемый для полной защиты ток обычно бывает чрезмерно велик. Следует иметь в виду, что такой ток часто будет вызывать вредный побочный эффект, например чрезмерное защелачивание. Поэтому катодная защита применяется в сочетании с некоторыми видами покрытий. Явление пассивности
Скорость коррозии многих металлов часто значительно меньше в растворах сильных окислителей, чем в растворах окислителей более слабых. Сюда относятся такие металлы, как железо, хром, никель, титан, цирконий, алюминий и многие другие. Резкое уменьшение скорости коррозии в сильных окислителях называется пассивацией, а состояние металла - пассивным. Пассивное состояние обусловлено образованием очень тонкой пленки окисла, представляющего собой отдельную фазу, или слоя хемисорбированного кислорода, а может быть и других частиц. Ограничимся представлением о некотором кислородном «барьере», образующемся на поверхности металла в подходящем окислителе и сильно тормозящем анодный процесс.
Рис. 5. Полная анодная поляризационная кривая: I- активное растворение; II- переход в пассивное состояние; III- пассивность; IV- перепассивация; V- выделение кислорода.
На рис.5 приведена анодная кривая. Активное растворение продолжается до потенциала, отвечающего точке b. При этом ток равен критическому току пассивации iп, а потенциал обозначен символом φп. На участке be (в интервале потенциалов φп - φпп) происходит пассивация. φппи iпп можно назвать потенциалом и током полной (наилучшей) запассивированности. Это название не вполне точно, так как на реальных поляризационных кривых линия cd редко бывает строго горизонтальной; но сравнительно небольшими вариациями тока iпп в интервале cd часто можно пренебречь. Потенциал φп и ток iп являются важными характеристиками электрода, показывающими, насколько легко металл переходит в пассивное состояние. Чем отрицательнее φп и чем меньше iп, тем легче наступает пассивность. Интервал потенциалов ∆φn отвечает условиям, в которых сохраняется пассивное состояние. Чем больше ∆φп, тем в более широких пределах изменение потенциала будет сохранять пассивное состояние. Выше потенциала φ'пп скорость окисления снова увеличивается (участок de) и металл оказывается в области перепассивации или в транспассивном состоянии. Иными словами, отклонение значения потенциала от равновесного значения называется перепассивацией. При еще более высоком потенциале становится возможным процесс окисления ионов гидроксила и выделение кислорода: 4OН-—► 2H2O + O2 + 4е. Это соответствует участку fg. Если этот последний процесс определяет кинетику анодной реакции, то угловой коэффициент прямой fg соответствует окислению ионов ОН-. При изменении потенциала в обратном направлении кривая, вообще говоря, имеет такой же ход. В таком случае φпп будет потенциалом начала потери пассивности (депассивации). Его иногда называют фладе-потенциалом (φf) по имени исследователя, изучавшего депассивацию железа. В настоящее время вопрос сводится к изучению природы защитных образований на металле, в которых обычно участвует кислород. При более высоком потенциале становится возможным процесс выделения кислорода:
Между адсорбированным кислородом и металлом возникают химические связи (хемисорбция), иначе говоря, на поверхности металла возникает хемисорбированная пленка:
Из-за неоднородности поверхности пленка может где-то образовываться, а где-то нет. Там, где есть пленка, не происходит окисления металла.
Анодная защита. Использование пассивности в практике зашиты от коррозии
Многие металлы находятся в пассивном состоянии в некоторых агрессивных средах: хром, никель, титан, цирконий легко переходят в пассивное состояние и устойчиво его сохраняют. Для практического использования пассивности нужно такое сочетание свойств металла и среды, при котором последняя обеспечивает значение стационарного потенциала, лежащего в области ∆φn. Смещение потенциала активного металла в отрицательную сторону должно уменьшить скорость коррозии. Если потенциал становится отрицательнее равновесного в данной среде, то скорость коррозии должна стать равной нулю (катодная защита, применение протекторов). Подобным образом, за счет анодной поляризации от внешнего источника электрической энергии можно перевести способный к этому металл в пассивное состояние и тем уменьшить скорость коррозии на несколько порядков. Расход электрической энергии не должен быть велик, так как сила тока в области ∆φn вообще весьма мала. Существуют требования, которым должна удовлетворять система, чтобы к ней можно было применить анодную защиту. Прежде всего, нужно надежно знать анодную поляризационную кривую для выбранного металла в данной агрессивной среде. Чем выше in , тем большая сила тока потребуется для перевода металла в пассивное состояние; чем меньше inn , тем меньший расход энергии потребуется для поддержания пассивности. Чем шире диапазон ∆φn, тем большие колебания потенциала можно допустить, т.е. тем легче поддерживать металл в пассивном состоянии. Нужна уверенность в том, что в области ∆φn металл корродирует равномерно. В противном случае, даже при малой величине iпп, возможно образование язв и сквозного разъедания стенки изделия. Форма защищаемой поверхности может быть довольно сложной, что затрудняет поддержание одинакового значения потенциала на всей поверхности; в этом отношении большая величина ∆φn особенно желательна. Конечно, требуется и достаточно хорошая электропроводность среды. Анодная защита может осуществляться несколькими способами. 1. Простое наложение постоянной э.д.с. от постороннего источника электрической энергии. Положительный полюс подключается к защищаемому изделию, а около его поверхности помещают катоды сравнительно малого размера. Они размещаются в таком количестве и на таком расстоянии от защищаемой поверхности, чтобы обеспечить по возможности равномерную анодную поляризацию изделия. Этот способ применяется в том случае, если ∆φn достаточно велик и нет опасности при некоторой неизбежной неравномерности распределения потенциала анода, активации или перепассивации, т.е. выхода за пределы ∆φn. 2.Периодическое включение и выключение тока защиты, когда изделие уже запассивировано. При включении анодного тока потенциал изделия смещается в отрицательную сторону, причем может произойти депассивация. Но поскольку иногда это происходит довольно медленно, простая автоматика может обеспечить включение и выключение защитного тока в нужное время. Когда потенциал дойдет до величины φ'пп, т.е. до начала перепассивации, ток выключается; когда потенциал сдвинется в отрицательную сторону до φпп (начало активации), ток снова включается. Смещение потенциала в катодную сторону происходит тем медленнее, чем меньше iпп. Чем ближе был потенциал к величине φ'пп, тем медленнее он смещается в отрицательную сторону (в направлении φпп) при выключении тока. Например, для хрома в 0,1н растворе H2SO4 при 750C, если выключение тока произошло при φ=0,35В, активация наступит через 2 ч; выключение тока при φ=0,6В вызывает активацию через 5 ч; выключение же при φ=1,05В увеличивает срок начала активации более чем до 127 ч. Столь большое время, необходимое для депассивации, позволяет делать значительные перерывы в подаче тока. Зависимость времени запассивации от потенциала включения легко объяснима при помощи концепции фазового окисла (образуется более толстый слой окисла, растворение которого требует больше времени). 3. Если область пассивного состояния (∆φn) мала, то необходимо применение потенциостата, поддерживающего заданную величину потенциала (относительно некоторого электрода сравнения) в узких границах. Потенциостат должен быть способен давать большую силу тока. В то время как катодная защита может употребляться для защиты многих металлов, погруженных в любую электропроводящую среду, например твердую или жидкую, анодная защита применяется только для защиты целых секций химических установок, которые изготовлены из металла, способного пассивироваться в рабочей среде. Именно это и ограничивает ее применение. Анодная защита не обеспечивает стойкости в присутствии агрессивных ионов. Так, хлоридные ионы разрушают пассивную пленку, а потому их концентрация должна поддерживаться низкой, за исключением защиты титана, который может пассивироваться в хлористоводородной кислоте. Анодная защита потребляет очень мало энергии и может применяться для защиты обычных конструкционных металлов, способных пассивироваться, например углеродистой и нержавеющей стали, во многих средах. Покрытия, как метод защиты металлов от коррозии
Защита металлов, основанная на изменении их свойств, осуществляется или специальной обработкой их поверхности, или легированием. Обработка поверхности металла с целью уменьшения коррозии проводится одним из следующих способов: покрытием металла поверхностными пассивирующими пленками из его труднорастворимых соединений (окислы, фосфаты, сульфаты, вольфраматы или их комбинации), созданием защитных слоев из смазок, битумов, красок, эмалей и т.п. и нанесением покрытий из других металлов, более стойких в данных конкретных условиях, чем защищаемый металл (лужение, цинкование, омеднение, никелирование, хромирование, свинцевание, радирование и т.д.). Защитное действие большинства поверхностных пленок можно отнести за счет вызванной ими механической изоляции металла от окружающей среды. Повышение устойчивости железных и стальных изделий при покрытии их поверхности осадками других металлов обусловлено и механической изоляцией поверхности, и изменением ее электрохимических свойств. При этом может наблюдаться или смещение обратимого потенциала анодной реакции в сторону более положительных значений (покрытия медью, никелем, родием), или увеличение поляризации катодной реакции - повышение водородного перенапряжения (цинк, олово, свинец). Обработку поверхности металлов применяют для предохранения машин, оборудования, аппаратов и предметов домашнего обихода при временной защите в условиях транспортировки, хранения и консервации (смазка, пассивирующие пленки) и для более длительной защиты при их эксплуатации (лаки, краски, эмали, металлические покрытия). Общим недостатком этих металлов является то, что при удалении (например, вследствие износа или повреждения) поверхностного слоя скорость коррозии на поврежденном месте резко возрастает, а повторное нанесение защитного покрытия не всегда бывает возможно. В этом отношении легирование является значительно более эффективным (хотя и более дорогим) методом повышения коррозионной стойкости металлов. Примером повышения коррозийной стойкости металла легированием являются сплавы меди с золотом. Для надежной защиты меди необходимо добавлять к ней значительное количество золота (не менее 52,2 ат.%). Атомы золота механически защищают атомы меди от их взаимодействия с окружающей средой. Несравненно меньше количество легирующих компонентов требуется для повышения устойчивости металла, если эти компоненты способны образовывать с кислородом защитные пассивирующие пленки. Так, введение хрома в количестве нескольких процентов резко увеличивает коррозионную стойкость. Ингибиторы коррозии
Уменьшить или полностью исключить коррозию металлической аппаратуры можно введением в агрессивную среду соединений, значительно снижающих коррозионный процесс. Такой способ снижения скорости коррозии называют ингибированием, а вводимые в среду вещества - ингибиторами, или замедлителями, коррозии. Ингибирование применяют только в системах с постоянным объемом агрессивного раствора, например при защите резервуаров, цистерн, травильных ванн, паросиловых установок, при снятии накипи и т.д. Концентрация вводимого ингибитора зависит от состава и свойств среды, температуры, рН раствора и др. Эффективность его защиты определяется защитным действием (эффектом) (Z,%) и коэффициентом ингибирования (J):
где K0- массовый показатель скорости коррозии в среде без ингибитора, г/(м2 * ч); К1 - массовый показатель скорости коррозии в среде с ингибитором, г/(м 2 *ч). Пересчет одного критерия в другой осуществляется следующим образом:
На эффективность действия ингибиторов коррозии влияют внешние и внутренние факторы коррозии. Среди них наиболее важные: рН среды и концентрация ингибитора. Механизм действия замедлителей коррозии в большинстве случаев имеет электромеханический характер, т.е. одни вещества, вводимые в состав среды, замедляют анодный, а другие - катодный процесс или одновременно обе стадии процесса. По характеру защитного действия применяемые ингибиторы подразделяются на катодные, анодные и органические. К анодным замедлителям относятся вещества, обладающие окислительными свойствами (хроматы, дихроматы, нитриты и др.). Они образуют на анодной поверхности металла или сплава пассивные, чаще всего оксидные пленки толщиной 0,01 мкм и уменьшают скорость его растворения. Уменьшение скорости коррозии достигается непосредственным торможением перехода металла в раствор или сокращением поверхности анода из-за образования защитных пленок. К катодным замедлителям относятся вещества, способные тормозить отдельные стадии катодного процесса. Например, в процессах, идущих с кислородной деполяризацией, скорость коррозии уменьшается при снижении концентрации кислорода в растворе. Поэтому введение поглотителей кислорода в раствор (Na2SO3) снижает скорость коррозии. Можно уменьшить коррозию, применяя катодные замедлители, сокращающие поверхность катодных участков (к ним относятся ZnSO4, ZnCl2 и др.) Снижение скорости коррозии при введении этих соединений объясняется образованием в щелочной среде нерастворимого соединения Zn(OH)2, которое осаждается на стенках аппаратов, изолирует поверхность катода от соприкосновения с раствором. Анодные и катодные замедлители (как правило, неорганические соединения) снижают коррозию в нейтральных и щелочных средах, но не оказывают защитного действия в кислых средах. Коррозия металлов в растворах кислот протекает с водородной деполяризацией. Для ее предотвращения применяются ингибиторы, повышающие перенапряжение восстановления ионов водорода и реакции ионизации металла. Введение кислотных ингибиторов уменьшает скорость коррозии в этих средах в десятки и сотни раз. К органическим замедлителям коррозии относятся органические коллоиды, поверхностно - активные вещества и другие соединения. Органические ингибиторы адсорбируются на поверхности металла, причем не на всей поверхности, а лишь только на катодных, активных ее участках, тормозя разряд ионов водорода, а, следовательно, разрушения металла. Органические ингибиторы не адсорбируются окислительной поверхностью или продуктами коррозии, находящимися на ней, поэтому они будут разрушатся под действием агрессивной среды. Защитное действие органических ингибиторов зависит не только от природы этих веществ, но и от температуры и концентрации их в агрессивной среде. С повышением температуры уменьшается адсорбция их поверхностью и резко снижается защитное действие. Концентрация ингибитора в растворе должна быть строго определенной. В полиметаллических системах необходимо применять смеси ингибиторов, действие которых на металлоконструкции неодинаково. Возможно равнозначное действие отдельных ингибиторов, ослабление эффективности (антагонизм), увеличение эффективности (синергизм). Наиболее полезен эффект синергизма, который приводит к достижению большего защитного эффекта. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|