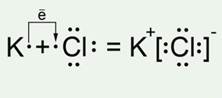|
|
Характеристика веществ с разным типом химической связи12 Ионная связь образуется между ионами, а ковалентная связь возникает при перекрывании электронных орбиталей, при котором пара электронов становится общей для обоих атомов. Рассмотрим на конкретных примерах условия и схемы образования каждого вида химической связи: ионная связь, ковалентная полярная и ковалентная неполярная связь. Сравнение сведений о различных типах химической связи. Определим вид химической связи в следующих веществах: фтор F2, вода Н2О и хлорид калия KCl Схема образования ковалентной неполярной связи
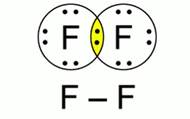
Рис. 1. Схема образования связи в молекуле фтора Молекула фтора состоит из двух атомов одного химического элемента-неметалла с одинаковой электроотрицательностью, следовательно, в этом веществе реализуется ковалентная неполярная связь. Изобразим схему образования связи в молекуле фтора. Рис. 1. Вокруг каждого атома фтора с помощью точек нарисуем семь валентных, то есть внешних, электронов. До устойчивого состояния каждому атому необходим еще один электрон. Таким образом, образуется одна общая электронная пара. Заменив ее черточкой, изобразим графическую формулу молекула фтора F-F. Вывод:ковалентная неполярная связь образуется между молекулами одного химического элемента-неметалла. При таком типе химической связи образуются общие электронные пары, которые в равной степени принадлежат обоим атомам, то есть не происходит смещения электронной плотности ни к одному из атомов химического элемента Схема образования ковалентной полярной связи
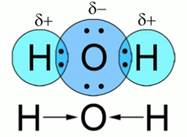
Рис. 2. Схема образования связи в молекуле воды Молекула воды состоит из атомов водорода и кислорода – двух элементов-неметаллов с разными значениями относительной электроотрицательности, следовательно, в этом веществе – ковалентная полярная связь. Так как кислород – более электроотрицательный элемент, чем водород, общие электронные пары смещаются в сторону кислорода. На атомах водорода возникает частичный заряд, а на атоме кислорода – частичный отрицательный. Заменив обе общие электронные пары черточками, а точнее стрелками, показывающими смещение электронной плотности, запишем графическую формулу воды Рис. 2. Вывод:ковалентная полярная связь возникает между атомами разных элементов-неметаллов, то есть с разными значениями относительной электроотрицательности. При этом типе связи образуются общие электронные пары, которые смещаются в сторону более электроотрицательного элемента. Схема образования ионной связи
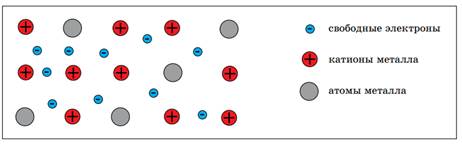
Рис. 3 Схема образования ионной связи в хлориде калия В состав хлорида калия KCl входят два химических элемента: калий – типичный металл и хлор – типичный неметалл. Это химические элементы с сильно различающимися значениями относительной электроотрицательности. Значит, хлорид калия – это ионное соединение. Калий отдает один внешний электрон атому хлора, при этом образуется катион калия, а хлор притягивает один электрон, образуя хлорид-анион. Рис. 3. Вывод: ионная связь возникает между ионами, образованными из атомов типичного металла и типичного неметалла, причем, разница в значениях относительной электроотрицательности данных химических элементов должна быть достаточно значительной. Подведение итога урока На этом уроке вы рассмотрели схемы образования веществ с различным типом химической связи. Было проведено обобщение сведений о различных видах химической связи и сравнение их между собой. МЕТАЛЛИЧЕСКАЯ СВЯЗЬ Попробуем объяснить, почему металлы обладают общими физическими и химическими свойствами. Для этого рассмотрим модель внутреннего строения металла. Атомы металлов имеют относительно большие радиусы и малое число внешних электронов. Эти электроны слабо притягиваются к ядру, поэтому в химических реакциях металлы выступают в роли восстановителей, отдавая электроны с внешнего энергетического уровня. В узлах кристаллической решетки металлов находятся не только нейтральные атомы, но и катионы металла, т.к. внешние электроны свободно перемещаются по кристаллической решетке. При этом атомы, отдавая электроны, становятся катионами, а катионы, принимая электроны, превращаются в электронейтральные атомы.
Рис. 4. Модель внутреннего строения металла Химическую связь, которая образуется в результате притяжения катионов металла к свободно перемещающимся электронам, называютметаллической. Электро– и теплопроводность металлов объясняются наличием свободных электронов, которые могут быть носителями электрического тока и переносчиками теплоты. Пластичность металла объясняется тем, что при механическом воздействии не рвется химическая связь, т.к. химическая связь устанавливается не между конкретными атомами и катионами, а между всеми катионами металла со всеми свободными электронами в кристалле металла.

12 Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|