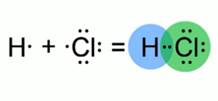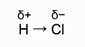|
|
Физические свойства веществ с ионной связью12 Введение понятия ковалентной полярной связи Тема сегодняшнего урока «Ковалентная полярная связь». На прошлом уроке вы познакомились с моделью химической связи, которая реализуется в простых веществах-неметаллах. Такой вид связи называется «ковалентная неполярная связь». Сегодня вы узнаете о другом виде ковалентной связи, которая образует молекулы сложных веществ. Ковалентная полярная связь в молекуле хлороводорода
Рис. 1. Образование молекулы хлороводорода Зная, что ковалентная связь образуется за счет общих электронных пар, изобразим модель молекулы хлороводорода. Атом водорода имеет на внешнем электронном слое всего один электрон. Атом хлора – семь электронов. Эти атомы приобретут энергетически выгодное состояние, если атому водорода будет принадлежать два электрона, а атому хлора – восемь. Такое возможно при образовании одной общей электронной пары. Связь, образующаяся между водородом и хлором, в молекуле хлороводорода отличается от той химической связи, которая реализуется в молекулах простых веществ водорода и хлора. Это подтверждают экспериментальные данные. Например: атом водорода в молекуле HCl, может замещаться на атомы металла, а раствор хлороводорода в воде проводит электрический ток. 2HCl+Zn=ZnCl2+H2↑ Электроотрицательность Атомы разных химических элементов обладают различной способностью притягивать к себе электроны. Шкала электроотрицательности Способность атома оттягивать к себе электроны, участвующие в образовании связи, называется электроотрицательностью.
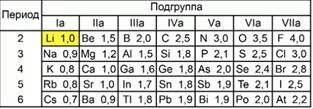
Рис. 2. Шкала относительной электроотрицательности элементов Лайнус Полинг предложил шкалу значений относительной электроотрицательности, приняв электроотрицательность лития за единицу. При этом он сравнивал электроотрицательность остальных атомов в химических элементах с электроотрицательностью лития. Максимальную электроотрицательностьимеет атом фтора, ее значение равно 4. В соответствии с этой шкалой, относительная электроотрицательность водорода меньше, чем значение относительнойэлектроотрицательности хлора.
Рис. 3. Частичные заряды атомов в молекуле хлороводорода Значит, общая электронная пара, и электронная плотность будут смещены к атому хлора. Обратите внимание на то, что нет полного перехода электрона от атома водорода к атому хлора, а лишь смещается электронная плотность в сторонуболее электроотрицательного элемента. Таким образом, на атомах этих элементов образуются частичные заряды, которые обозначаются греческой буквой «δ». На атоме водорода δ+, на атоме хлора δ-.Рис.3. Ковалентная полярная связь в молекулах Химическую связь, образованную элементами-неметаллами с разной электроотрицательностью, называют ковалентной полярной связью. Теперь, зная модель химической связи в молекуле хлороводорода, мы можем объяснить, почему раствор хлороводорода в воде становится электропроводным. Откуда там берутся заряженные частицы? Дело в том, что под действием молекул воды образуются не частичные, а целочисленные заряды на атомах H и Cl. Таким образом, в раствор переходят заряженные частицы – ионы, и такой раствор способен проводить электрический ток. Между атомами неметаллов образуется ковалентная связь. Ковалентная неполярная связь образуется между атомами одного химического элемента. Ковалентная полярная связь образуется между различными атомами неметаллов. При образовании ковалентной полярной связи общие электронной пары смещаются в сторону наиболее электроотрицательного элемента. Подведение итога урока Вы рассмотрели модель образования ковалентной полярной связи в молекулах сложных веществ. На следующем уроке вы узнаете, как изменяются значения относительной электроотрицательности элементов в главных подгруппах и периодах.
Тема: Химическая связь. Электролитическая диссоциация Урок: Ионная связь Валентность Лишь немногие химические элементы могут существовать в индивидуальном виде в виде газов. Эти элементы называются инертными газами. Остальные химические элементы будут взаимодействовать друг с другом или с другими атомами, образуя соединения. Причиной образования этих химических соединений является химическая связь. Химическая связь обусловлена электростатическим взаимодействием заряженных частей атома: ядра и электронной оболочки. Доказано, что в образовании химической связи принимают участие электроны внешней электронной оболочки. Такие электроны называются валентными. - Способность атома к образованию химической связи называется валентностью. Электроны в атомах располагаются на энергетических уровнях. Полностью заполненным энергетическим уровнем обладают электроны VIII-А группы - благородные или инертные газы. Учитывая химическую пассивность инертных газов и строение атомов соответствующих элементов, приходим к такому выводу: внешняя 8-электронаая оболочка является для атома выгодной и устойчивой. Её часто называют электронным октетом. Поскольку электронная конфигурация благородного газа очень устойчива, (ns2np6) то достичь её стремятся атомы других элементов. Сделать это они могут, отдав электроны, приняв или обобществив свои электроны с электронами других атомов. Способы образования химической связи различны, поэтому и выделяют несколько типов химической связи: - Ковалентная связь; - Водородная связь; - Металлическая связь; - Ионная связь. Каждый химический элемент обладает своей способностью притягивать к себе внешние, чужие электроны.
Электроотрицательность - Способность атома притягивать к себе электроны называетсяэлектроотрицательностью.
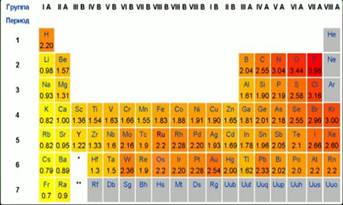
Рис. 1. Шкала Полинга Электроотрицательность нельзя выразить в единицах любых физических величин. Поэтому было разработано несколько шкал относительной электроотрицательности. Наибольшее признание получила шкала электроотрицательности, разработанная Л.К. Полингом. Рис.1. Л.К. Полинг один из известнейших ученых XX- века. Он один из немногих, дважды нобелевский лауреат. В 1954 году ему была вручена Нобелевская премия по химии с формулировкой « За изучение природы химической связи и его применения к структуре сложных молекул» Чем меньше электронов требуется атому для завершения внешнего электронного уровня, тем большим значением электроотрицательности он обладает. Например, если сравнить хлор и серу, то большим значением электроотрицательности будет обладать хлор. Ему до достижения октета электронов требуется всего 1 электрон, а атому серы – 2.Рис.2.
Рис. 2. Электронная конфигурация внешнего слоя В периодеэлектроотрицательность будет возрастатьслева направо. Если же рассматривать элементы одной группы, которые имеют на внешнем слое одинаковое количество электронов, то большим значением электроотрицательности будет обладать тот элемент, у которого меньше радиус. Т.е. тот, который находится выше по группе. Сравнивая фтор и хлор можно с уверенностью сказать, что фтор 9F …2s22p5обладает большей электроотрицательностью, чем хлор 17Cl…3s23p5 . Фтор самый электроотрицательный элемент. Наименьшим значением электроотрицательности обладают щелочные металлы. Ионная связь Ионная связь – это связь между атомами резко отличающимися по электроотрицательности: у одного она очень высокая, у другого – низкая. В этом случае, атом с меньшей электроотрицательностью полностью отдает свои валентные электроны атому с большей электроотрицательностью. Ионная связь образуется между металлами и неметаллами. Такой тип связи в NaCl, CsBr, NH4Cl и др. При образовании ионной связи образуются заряженные частицы: ионы. Катионы – положительно заряженные ионы. Их образуют атомы, в которых мало валентных электронов и они слабо связаны с ядром. Это атомы щелочных и щелочноземельных металлов. Анионы – отрицательно заряженные ионы. Их легче всего образуют галогены. Элементы главной подгруппы 7 группы. До завершения валентного уровня им не хватает всего одного электрона. Схема образования ионной связи на примере хлорида натрия.
Атом натрия, имеет на внешнем уровне всего один электрон. Он легко отдает его, превращаясь в катион натрия Na+.Атому хлора до октета электронов не хватает одного электрона. Он его забирает у атома натрия, превращаясь в анион хлора Cl-. - Ионная связь возникает за счет сил электростатического притяжения разноименно заряженных ионов. Физические свойства веществ с ионной связью
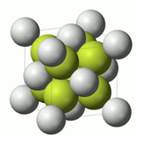
Рис. 3. Ионные соединения
Рис. 4. Кристаллическая решетка фторида кальция Вещества, образованные из ионов, называются ионными соединениями. Рис.3. Соединения, образованные ионной связью при обычных условиях твёрдые вещества с высокой температурой плавления и кипения. Это хрупкие вещества. Они образуют ионную кристалличекую решетку. В узлах кристаллической решетки находятся ионы. На рисунках показаны кристалличекие решетки хлорида натрия и фторида кальция. Рис. 4,5.
Рис. 5. Кристаллическая решетка хлорида натрия Таким образом, можно сделать вывод, что соединения двух элементов, расположенных в противоположных концах одного (или разных) периодов, имеют преимущественно ионный характер связи, но по мере сближения элементов в пределах периода ионный характер их соединений уменьшается. В большинстве случаев нельзя сказать, что соединение является полностью (или чисто) ионным либо полностью (или чисто) ковалентным. Однако можно утверждать, что некоторые соединения являются преимущественно ионными, а другие соединения преимущественно ковалентными. Хорошими примерами ионных соединений являются хлориды и оксиды. Хлориды и оксиды элементов, расположенных в левой части периодической таблицы, как правило, имеют преимущественно ионный характер. Подведение итога урока. На этом уроке вы узнали, что такое ионная связь. Вы повторили, как образуются новые химические соединения, какие элементы никогда не взаимодействуют друг с другом. Рассмотрели причины образования ионной связи, которые проанализировали на конкретных примерах.
Тема: Химическая связь. Электролитическая диссоциация Урок: Схемы образования веществ с различным типом связиhttp://interneturok.ru/ru/school/chemistry/9-klass/bhimicheskaya-svyaz-elektroliticheskaya-dissociaciyab/kovalentnaya-svyaz 
12 Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|