|
|
Следствия из закона Гесса· Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье — Лапласа). · Тепловой эффект химической реакции равен разности сумм теплот образования (ΔHf) продуктов реакции и исходных веществ, умноженных на стехиометрическиекоэффициенты (ν):
· Тепловой эффект химической реакции равен разности сумм теплот сгорания (ΔHc) исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты (ν):
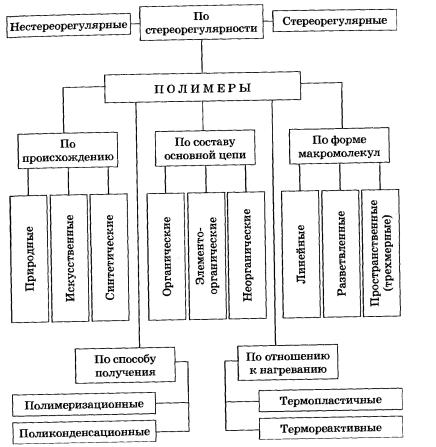
Таким образом, пользуясь табличными значениями теплот образования или сгорания веществ, можно рассчитать теплоту реакции, не прибегая к эксперименту. Табличные величины теплот образования и сгорания веществ обычно относятся к т. н. стандартным условиям. Для расчёта теплоты процесса, протекающего при иных условиях, необходимо использовать и другие законы термохимии, например, закон Кирхгофа, описывающий зависимость теплового эффекта реакции от температуры · Если начальное и конечное состояния химической реакции (реакций) совпадают, то её (их) тепловой эффект равен нулю. 18.Энтропи́я (от др.-греч. ἐντροπία — поворот, превращение) — широко используемый в естественных и точных науках термин. Впервые введён в рамках термодинамики как функция состояния термодинамической системы, определяющая меру необратимого рассеивания энергии. В статистической физике энтропия является мерой вероятности осуществления какого-либо макроскопического состояния. Кроме физики, термин широко употребляется в математике: теории информации и математической статистике. Энтропия может интерпретироваться как мера неопределённости (неупорядоченности) некоторой системы (например, какого-либо опыта (испытания), который может иметь разные исходы, а значит, и количество информации[1][2]). Другой интерпретацией этого понятия является информационная ёмкость системы. С данной интерпретацией связан тот факт, что создатель понятия энтропии в теории информацииКлод Шеннон сначала хотел назвать эту величину информацией. В широком смысле, в каком слово часто употребляется в быту, энтропия означает меру неупорядоченности системы; чем меньше элементы системы подчинены какому-либо порядку, тем выше энтропия. 19.Химическая кинетика: или кинетика химических реакций — раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений. Гомогенные и гетерогенные системы: Гомогенная система – система, состоящая из одной фазы. Гетерогенная система – система, состоящая из двух или большего числа фаз. Фаза – часть системы, однородная по составу и строению и отделенная от других частей системы (других фаз) границей раздела (межфазной границей). Скорость реакции: — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятием химической кинетики. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение умножаетсяна −1. 29. Свойства растворов неэлектролитов с концентрацией растворенного вещества меньше, чем 0 001 мольных долей, хорошо подчиняются законам Рауля, Генри, Вант-Гоффа. Однако этим законам не подчиняются растворы электролитов. Так, вычисленные значения упругости пара ( Р), температур кипения ( Тк) и замерзания ( Ts), осмотического давления растворов электролита росм) всегда оказываются заниженными по сравнению с опытными. [1] Идеа́льными раство́рами называют растворы, в которых предполагается отсутствие взаимодействий между частицами составляющих веществ, а химический потенциал каждого компонента имеет простую зависимость отконцентрации. Для идеальных растворов энтальпия смешения и изменения объема при смешении равны нулю, энтропия смешения определяется так же, как и для идеальных газов. Для идеальных растворов выполняются законы Рауля и Генри. Идеальные растворы делятся на бесконечно-разбавленные и совершенные Зако́ны Ра́уля — общее название открытых французским химиком Ф. М. Раулем в 1887 году количественных закономерностей, описывающих некоторые коллигативные (зависящие от концентрации, но не от природы растворённого вещества) свойства растворов. 30.О́смос (от греч. ὄσμος — толчок, давление) — процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону бо́льшей концентрации растворённого вещества из объёма с меньшей концентрацией растворенного вещества. Осмотическое давление (обозначается π) — избыточное гидростатическое давление на раствор, отделённый от чистого растворителя полупроницаемой мембраной, при котором прекращается диффузия растворителя через мембрану (осмос). Это давление стремится уравнять концентрации обоих растворов вследствие встречной диффузии молекул растворённого вещества и растворителя. Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). 31.Электроли́т — вещество, которое проводит электрический ток вследствие диссоциации на ионы, что происходит врастворах и расплавах, или движения ионов в кристаллических решётках твёрдых электролитов. Примерами электролитов могут служить водные растворы кислот, солей и оснований и некоторые кристаллы (например, иодид серебра, диоксид циркония). Электролиты — проводники второго рода, вещества, электропроводность которых обусловлена подвижностью положительно или отрицательно заряженных ионов. Законы Вант-Гоффа и Рауля справедливы для идеальных растворов, в которых не происходит химическое взаимодействие между компонентами раствора, а также диссоциация или ассоциация молекул растворенного вещества. Однако опыт показывает, что не все растворы подчиняются этим законам. Установлено, что растворы, которые способны проводить электрический ток (электролиты), имеют более высокое, чем по закону Вант-Гоффа, осмотическое давление. Эти растворы кипят при более высокой температуре и замерзают при более низкой, чем это следует из закона Рауля. Такими свойствами обладают растворы солей, кислот и оснований. Изотонический коэффициент (также фактор Вант-Гоффа; обозначается i) — безразмерный параметр, характеризующий поведение вещества в растворе. Он численно равен отношению значения некоторого коллигативного свойства раствора данного вещества и значения того же коллигативного свойства неэлектролита той же концентрации при неизменных прочих параметрах системы: 32.Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении. 1) пропускание постоянного электрического тока через раствор электролита 2) взаимодействие электролита с полярными молекулами растворителя 3) взаимодействие электролита с неполярными молекулами растворителя 4) пропускание переменного электрического тока через раствор электролита Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах. 33.ничего не нашел 34.Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксида OH− в воде или в водных растворах, константа автопротолизаводы. Водоро́дный показа́тель, pH (лат. pondus Hydrogenii — «вес водорода», произносится «пэ аш») — мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, количественно выражающая его кислотность. Буферные растворы (англ. buffer, от buff — смягчать удар) — растворы с определённой устойчивой концентрацией водородных ионов. рН буферных растворов мало изменяется при прибавлении к ним небольших количеств сильного основания или сильной кислоты, а также при разбавлении и концентрировании. 35.Гидро́лиз (от др.-греч. ὕδωρ — вода + λύσις — разложение) — сольволиз водой. Это химическая реакция взаимодействия вещества с водой, при которой происходит разложение этого вещества и воды с образованием новых соединений. Гидролиз соединений различных классов (соли, углеводы, белки, сложные эфиры, жиры и др.) существенно различается. Нужно доработать вопрос 36. Процесс образования слабодиссоциированных соединений с изменением водородного показателя среды при взаимодействии воды и соли называется гидролизом. Гидролиз солей происходит в случае связывания одного иона воды с образованием труднорастворимых или слабодиссоциированных соединений за счет смещения равновесия диссоциации. По большей части этот процесс является обратимым и при разбавлении или увеличении температуры усиливается. 45. Полимеры. классификация. методы получения. Зависимость свойств и структуры полимеров. Полимерные смолы, каучуки.Свойства, примениние?
Глифта́левые смо́лы — термореактивные полиэфирные смолы, продукт поликонденсации глицерина НОСН2—СНОН—СН2ОН и фталевого ангидрида С8Н4О3. Олигомеры глифталевых смол растворимы в ацетоне, смеси спирта с бензолом и в других растворителях. Отвержденные глифталевые смолы не растворимы, поэтому немодифицированные глифталевые смолы (твердые продукты) не нашли применения. Отвержденные глифталевые смолы более эластичны, чем бакелит, более стойки к тепловому старению и более трекингостойки. Глифталевые смолы могут быть модифицированы в процессе их получения введением в реакционную смесь канифоли, придающей смоле способность совмещаться с маслами, твердость и блеск лакокрасочному покрытию, или ненасыщенных жирных кислот (обычно в виде растительных масел — льняного, тунгового, хлопкового) для придания покрытиям повышенной светостойкости, а также способности высыхать на воздухе при температуре около 20 °С. Модифицированные глифталевые смолы используются в производстве лаков и клеев, в том числе и электроизоляционных. Бутадие́новые каучу́ки́ (дивиниловые каучуки, полибутадиены) — группа синтетических каучуков, продуктов полимеризации бутадиена. В зависимости от условий полимеризации и природы катализатора бутадиена могут образовываться полимеры с различной конфигурацией химических звеньев в макромолекуле. В присутствии щелочных катализаторов получают нестереорегулярные бутадиеновые каучуки, в присутствии координационно-ионных катализаторов или металлорганических соединений получают стереорегулярные полимеры. Первый в мире промышленный синтетический каучук — нестереорегулярный натрий-бутадиеновый каучук (СКБ) — был получен в СССР в 1932 году. Бутадиеновые каучуки известны под названиями СКД, СКДЛ, америпол, буден, буна СВ, диен, интен, карифлекс BR, коперфлекс, нипол BR, солпрен, эуропрен-цис. Плотность бутадиеновых каучуков при 20 °С составляет 900-920 кг/м3. Они растворимы в бензине, бензоле, хлороформе, однако, растворимость уменьшается при нагреве, под действием кислорода, озона, ультрафиолетовых лучей, ионизирующих излучений. Для вулканизации стереорегулярных бутадиеновых каучуков применяют серу, органические дисульфиды, перекиси, алкилфеноло-формальдегидные смолы, для вулканизации нестереорегулярных используют, главным образом, серу. Наполнителями служат активные сажи. Бутадиеновые каучуки относятся к каучукам общего назначения. Нестереорегулярный натрий-бутадиеновый каучук используют в производстве технических и бытовых резиновых изделий. Стереорегулярные бутадиеновые каучуки, обладающие более высокой морозостойкостью (до -65 оС), применяют в производстве шин, транспортерных лент, износостойких и морозостойких изделий. Бутилкаучу́к — синтетический каучук, с общей формулой [-С(СН3)2СН2-]n—(-СН2-С(СН3)=СН-СН2-]m, продукт полимеризации изобутилена с небольшими количествами изопрена. Макромолекулы бутилкаучука имеют линейное строение. Бутилкаучук не растворяется в спиртах, эфирах, кетонах, дихлорэтане, анилине, нитробензоле, характеризуется низкой газопроницаемостью. Его плотность при 20 °С составляетя 920 кг/м3, температура стеклования -69 оС. Бутилкаучук получают катионной сополимеризацией мономеров в растворе хлористого метила или хлористого этила при температуре около 100 °С. Для вулканизации бутилкаучука используют серу или органические полисульфиды, одновременно добавляя высокоактивные ускорители. В качестве наполнителей резиновых смесей применяют технический углерод, неактивные минеральных наполнители, их смеси. В качестве пластификаторов применяют насыщенные соединения, такие, как нафтеновые и парафиновые масла, низкомолекулярный полиэтилен. На основе бутилкаучука производят резины, стойкие к действию озона, кислот, кислорода. Резины на основе бутилкаучука атмосферостойки, имеют низкую газопроницаемость, обладают хорошими электроизоляционными свойствами. Их используют для изоляции кабелей, применяют в производстве камер автомобильных шин. Жидкие бутилкаучуки являются основой герметиков, применяемых для изоляции стыков и заполнения щелей в строительных конструкциях.
Алки́дные смо́лы — полимеры, синтетические смолы, продукты поликонденсации многоосновных карбоновых кислот с многоатомными спиртами; высоковязкие жидкости; применяются главным образом для приготовления алкидных лаков. В зависимости от спирта, взаимодействующего с фталевым ангидридом, алкидные смолы подразделяются на глифталевые смолы, пентафталевые смолы и этрифталевые смолы. Наиболее распространены глифталевые смолы (глифтали), получаемые на основе фталевого ангидрида и глицерина или пентаэритрита и пентафталевые смолы (пентафтали) на основе фталевого ангидрида и пентаэритрита. Немодифицированные алкидные смолы являются твердыми продуктами и плохо растворяются. Они образуют хрупкие пленки, применяются главным образом для приготовления электроизоляционных лаков и клеев. Более широкое применение нашли лаки и эмали на основе модифицированных алкидных смол. Модифицирование алкидных смол осуществляется введением в реакционную смесь канифоли или ненасыщенных жирных кислот. Модифицирование канифолью обеспечивает смоле способность совмещаться с маслами, а модифицирование ненасыщенными жирными кислотами (растительные льняное, тунговое, хлопковое масла) придает покрытиям на основе алкидных смол повышенную светостойкость, а также способность высыхать на воздухе при комнатной температуре. При этом свойства модифицированных маслами алкидных смол зависят от содержания в них масла, то есть от их жирности. С увеличением жирности алкидных смол, увеличиваются эластичность и атмосферостойкость изготовленных на их основе покрытий, но замедляется их высыхание и уменьшаются твердость, глянец и стойкость к действию растворителей и смазочных масел. Алкидные лаки используются для покрытия деревянных поверхностей, в том числе для паркетных полов. Эмали на основе алкидных смол обладают высокими декоративными и коррозионно-защитными параметрами, применяются для покрытия поверхностей грузовых автомобилей, корпусов приборов, арматуры, используются при изготовлении противокоррозионных грунтовок. Также применение нашли сочетания алкидных смол с другими поликонденсационными и полимеризационными смолами. Анионообме́нные смо́лы (полиоснования, смоляные аниониты) — один из видов ионообменных смол; сетчатые синтетические полимеры, способные к обмену анионов при контакте с растворами электролитов. В полимерной матрице (каркасе) анионообменной смолы находятся положительные электрические заряды, которые компенсируются подвижными анионами, участвующими в обмене. По степени диссоциации ионогенных групп анионообменные смолы подразделяются на три типа: слабоосновные или низко-основные, средне-основные или промежуточно-основные, сильноосновные или высокоосновные. Слабые и средние смолы содержат первичные, вторичные, третичные аминогруппы, сильноосновные смолы — четвертичные аммониевые, пиридиниевые, фосфониевые, третичные сульфониевые группы. По структуре различают микропористые, или гелевые, и макропористые анионоосновные смолы. Гелевые смолы могут быть гетеропористыми или изопористыми; в полимерном каркасе изопористых гелевых смол поперечные связи расположены относительно регулярно, что способствует их повышенной проницаемости, способности обратимо сорбировать крупные органические ионы. Макропористые анионообменные смолы имеют губчатую (микрогетерогенную) структуру, пронизанную каналами с надмолекулярными размерами. Пористость таких смол, сохраняющаяся и после их высушивания, обеспечивает высокую скорость обменных процессов. Глифта́левые смо́лы — термореактивные полиэфирные смолы, продукт поликонденсации глицерина НОСН2—СНОН—СН2ОН и фталевого ангидрида С8Н4О3. Олигомеры глифталевых смол растворимы в ацетоне, смеси спирта с бензолом и в других растворителях. Отвержденные глифталевые смолы не растворимы, поэтому немодифицированные глифталевые смолы (твердые продукты) не нашли применения. Отвержденные глифталевые смолы более эластичны, чем бакелит, более стойки к тепловому старению и более трекингостойки. Глифталевые смолы могут быть модифицированы в процессе их получения введением в реакционную смесь канифоли, придающей смоле способность совмещаться с маслами, твердость и блеск лакокрасочному покрытию, или ненасыщенных жирных кислот (обычно в виде растительных масел — льняного, тунгового, хлопкового) для придания покрытиям повышенной светостойкости, а также способности высыхать на воздухе при температуре около 20 °С. Модифицированные глифталевые смолы используются в производстве лаков и клеев, в том числе и электроизоляционных. 44. металлы, способы получения металлов. Физическое, химические свойства металлов( отношение металлов к воде, кислоте, щелочем.) природа электропроводности? Мета́ллы— группа элементов, в виде простых веществ, обладающих характерными металлическими свойствами, такими, как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность, ковкость и металлический блеск. Из 118 химических элементов, открытых на данный момент (из них не все официально признаны), к металлам относят: 6 элементов в группе щелочных металлов: Li, Na, K, Rb, Cs, Fr. 4 в группе щёлочноземельных металлов: Ca, Sr, Ba, Ra а также вне определённых групп бериллий и магний 38 в группе переходных металлов: - Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn; - Y, Zr, Nb, Mo, Tc, Ru, Rh, Pd, Ag, Cd; - La, Hf, Ta, W, Re, Os, Ir, Pt, Au, Hg; 7 в группе лёгких металлов: Al, Ga, In, Sn, Tl, Pb, Bi 7 в группе полуметаллов[2]: B, Si, Ge, As, Sb, Te, Po 14 в группе лантаноиды + лантан (La): Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu 14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний (Ac): Th, Pa, U, Np, Pu, Am, Cm, Bk, Cf, Es, Fm, Md, No, Lr. Таким образом, к металлам, возможно, относится 94 элемента из всех открытых; все остальные являются неметаллами. В астрофизике термин «металл» может иметь другое значение и обозначать все химические элементы тяжелее гелия (см. Металличность).Кроме того, в физике металлам [как проводникам] противоставляется полупроводники и диэлектрики (см. также Полуметалл (спинтроника)) Бо́льшая часть металлов присутствует в природе в виде руд и соединений. Они образуют оксиды, сульфиды, карбонаты и другие химические соединения. Для получения чистых металлов и дальнейшего их применения необходимо выделить их из руд и провести очистку. При необходимости проводят легирование и другую обработку металлов. Изучением этого занимается наука металлургия. Металлургия различает руды чёрных металлов (на основе железа) и цветных (в их состав не входит железо, всего около 70 элементов). Золото, серебро и платина относятся также к драгоценным (благородным) металлам. Кроме того, в малых количествах они присутствуют в морской воде и в живых организмах. Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью. 43. Основные виды коррозии металлов, электрохимическая коррозия металлов. Методы защиты металлов от коррозии. ВИДЫ КОРРОЗИИ МЕТАЛЛОВ Наиболее часто встречаются следующие виды коррозии металлов: Равномерная – охватывает всю поверхность равномерно, Неравномерная, Избирательная, Местная пятнами – корродируют отдельные участки поверхности, Язвенная (или питтинг), Точечная, Межкристаллитная – распространяется вдоль границ кристалла металла, Растрескивающая, Подповерхностная. Электрохимическая коррозия металлов – это процесс разрушения металлов в среде различных электролитов, который сопровождается возникновением внутри системы электрического тока.
При таком типе коррозии атом удаляется из кристаллической решетки результате двух сопряженных процессов: Анодного – металл в виде ионов переходит в раствор. Катодного – образовавшиеся при анодном процессе электроны, связываются деполяризатором (вещество — окислитель). Сам процесс отвода электронов с катодных участков называется деполяризацией, а вещества способствующие отводу – деполяризаторами. Наибольшее распространение имеет коррозия металлов с водородной и кислородной деполяризацией. Водородная деполяризация осуществляется на катоде при электрохимической коррозии в кислой среде 2H++2e— = H2 разряд водородных ионов 2H3O++2e— = H2 + 2H2O Кислородная деполяризация осуществляется на катоде при электрохимической коррозии в нейтральной среде O2 + 4H++4e— = H2O восстановление растворенного кислород O2 + 2H2O + 4e— = 4OH— Все металлы, по их отношению к электрохимической коррозии, можно разбить на 4 группы, которые определяются величинами их стандартных электродных потенциалов: Активные металлы (высокая термодинамическая нестабильность) – это все металлы, находящиеся в интервале щелочные металлы — кадмий (Е0 = -0,4 В). Их коррозия возможна даже в нейтральных водных средах, в которых отсутствуют кислород или другие окислители. Металлы средней активности (термодинамическая нестабильность) – располагаются между кадмием и водородом (Е0 = 0,0 В). В нейтральных средах, в отсутствии кислорода, не корродируют, но подвергаются коррозии в кислых средах. Малоактивные металлы (промежуточная термодинамическая стабильность) – находятся между водородом и родием (Е0 = +0,8 В). Они устойчивы к коррозии в нейтральных и кислых средах, в которых отсутствует кислород или другие окислители. Благородные металлы (высокая термодинамическая стабильность) – золото, платина, иридий, палладий. Могут подвергаться коррозии лишь в кислых средах при наличии в них сильных окислителей. Электрохимическая коррозия может протекать в различных средах. В зависимости от характера среды выделяют следующие виды электрохимической коррозии: Коррозия в растворах электролитов — в растворах кислот, оснований, солей, в природной воде. Атмосферная коррозия – в атмосферных условиях и в среде любого влажного газа. Это самый распространенный вид коррозии. Например, при взаимодействии железа с компонентами окружающей среды, некоторые его участки служат анодом, где происходит окисление железа, а другие – катодом, где происходит восстановление кислорода: А: Fe – 2e— = Fe2+ K: O2 + 4H+ + 4e— = 2H2O Катодом является та поверхность, где больше приток кислорода. Почвенная коррозия – в зависимости от состава почв, а также ее аэрации, коррозия может протекать более или менее интенсивно. Кислые почвы наиболее агрессивны, а песчаные – наименее. Аэрационная коррозия — возникает при неравномерном доступе воздуха к различным частям материала. Морская коррозия – протекает в морской воде, в связи с наличием в ней растворенных солей, газов и органических веществ. Биокоррозия – возникает в результате жизнедеятельности бактерий и других организмов, вырабатывающих такие газы как CO2, H2S и др., способствующие коррозии металла. Электрокоррозия – происходит под действием блуждающих токов на подземных сооружениях, в результате работ электрических железных дорог, трамвайных линий и других агрегатов. Металлическое покрытие наносится на металл, который нужно защитить от коррозии, слоем другого металла, устойчивого к коррозии в тех же условиях. Если металлическое покрытие изготовлено из металла с более отрицательным потенциалом (более активный) , чем защищаемый, то оно называется анодным покрытием. Если металлическое покрытие изготовлено из металла с более положительным потенциалом (менее активный), чем защищаемый, то оно называется катодным покрытием.Например, при нанесении слоя цинка на железо, при нарушении целостности покрытия, цинк выступает в качестве анода и будет разрушаться, а железо защищено до тех пор, пока не израсходуется весь цинк. Цинковое покрытие является в данном случае анодным. Катодным покрытием для защиты железа, может, например, быть медь или никель. При нарушении целостности такого покрытия, разрушается защищаемый металл. Неметаллические покрытия. Такие покрытия могут быть неорганические (цементный раствор, стекловидная масса) и органические (высокомолекулярные соединения, лаки, краски, битум). Химические покрытия. В этом случае защищаемый металл подвергают химической обработке с целью образования на поверхности пленки его соединения, устойчивой к коррозии. Сюда относятся: оксидирование – получение устойчивых оксидных пленок (Al2O3, ZnO и др.); фосфатирование – получение защитной пленки фосфатов (Fe3(PO4)2, Mn3(PO4)2); азотирование – поверхность металла (стали) насыщают азотом; воронение стали – поверхность металла взаимодействует с органическими веществами; цементация – получение на поверхности металла его соединения с углеродом. Изменение состава технического металла также способствует повышению стойкости металла к коррозии. В этом случае в металл вводят такие соединения, которые увеличивают его коррозионную стойкость.Изменение состава коррозионной среды (введение ингибиторов коррозии или удаление примесей из окружающей среды) тоже является средством защиты металла от коррозии.Электрохимическая защита основывается на присоединении защищаемого сооружения катоду внешнего источника постоянного тока, в результате чего оно становится катодом. Анодом служит металлический лом, который разрушаясь, защищает сооружение от коррозии.Протекторная защита – один из видов электрохимической защиты – заключается в следующем.К защищаемому сооружению присоединяют пластины более активного металла, который называется протектором. Протектор – металл с более отрицательным потенциалом – является анодом, а защищаемое сооружение – катодом. Соединение протектора и защищаемого сооружения проводником тока, приводит к разрушению протектора. 42. Электролиз расплпвов, электролиз растворов. Электролиз с растворимым и нерастворимым анодом. Законы Фарадея. Воход по току. Примениние электориза. Электролиз – это окислительно – восстановительные реакции, протекающие на электродах, если через расплав или раствор электролита пропускают постоянный электрический ток. Катод – восстановитель, отдаёт электроны катионам. Анод – окислитель, принимает электроны от анионов. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|