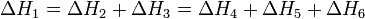|
|
КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВПростые вещества. Молекулы состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут разлагаться с образованием других веществ.
Сложные вещества (или химические соединения). Молекулы состоят из атомов разного вида (атомов различных химических элементов). В химических реакциях разлагаются с образованием нескольких других веществ. Основания - сложные вещества, в которых атомы металлов соединены с одной или несколькими гидроксильными группами (с точки зрения теории электролитической диссоциации, основания - сложные вещества, при диссоциации которых в водном растворе образуются катионы металла (или NH4+) и гидроксид - анионы OH-).
Оксиды - это сложные вещества, состоящие из двух элементов, один из которых кислород. Кислоты (кислотные гидроксиды). Соединяясь с водой, оксиды неметаллов образуют вещества, относящиеся к классу кислот. Такие кислоты называются кислородными(например, H2SO4, H2CO3, HNO3) в отличие от бескислородных кислот, не содержащих кислорода (например, HCI, HF). Соли — это продукты замещения атомов водорода в кислотах атомами металла или продукты замещения гидрокс групп в основаниях кислотными остатками. 3.Историю возникновения самых общих представлений об атоме обычно ведут со времен греческого философа Демокрита (ок. 460 – ок. 370 до н. э.), много размышлявшего о наименьших частицах, на которые можно было бы поделить любое вещество. Группу греческих философов, придерживавшихся того взгляда, что существуют подобные крошечные неделимые частицы, называли атомистами. Греческий философ Эпикур (ок. 342–270 до н.э.) принял атомную теорию, и в первом веке до н.э. один из его последователей, римский поэт и философ Лукреций Кар, изложил учение Эпикура в поэме «О природе вещей», благодаря которой оно и сохранилось для следующих поколений. Аристотель (384–322 до н.э.), один из крупнейших ученых древности, атомистическую теорию не принимал, и его взгляды на философию и науку преобладали впоследствии в средневековом мышлении. Атомистической теории как бы не существовало до самого конца эпохи Возрождения, когда на смену чисто умозрительным философским рассуждениям пришел эксперимент.
Ядерная модель атома Резерфорд на основании результатов эксперимента по рассеянию α-частиц на атомах металлической фольги обосновал планетарную модель строения атома. Согласно этой модели, атом состоит из тяжёлого положительно заряженного ядра очень малых размеров (~ 10-15 м ), вокруг которого по некоторым орбитам движутся электроны. Радиусы этих орбит имеют размеры ~ 10-10 м. Наличие у электрона заряда делает планетарную модель противоречивой с точки зрения классической физики, т.к. вращающийся вокруг ядра электрон, как и любая ускоренно движущаяся заряженная частица должен излучать электромагнитные волны. Спектр такого излучения должен быть непрерывным. В опытах наблюдается линейчатый спектр излучения атомов. Кроме того, непрерывное излучение уменьшает энергию электрона, и он из-за уменьшения орбиты обязан был бы упасть на ядро. 4.Корпускулярно-волновой дуализм.Из опытных фактов следует, что при взаимодействии с веществом свет обнаруживает корпускулярные свойства. Однако представление о свете как о потоке классических корпускул не совместимо с классическими представлениями об электромагнитных волнах (которые подтверждаются в явлениях интерференции и дифракции).
Для частиц не очень высокой энергии, движущихся со скоростью
5. КВАНТОВАЯ МЕХАНИКА, фундаментальная физическая теория динамического поведения всех элементарных форм вещества и излучения, а также их взаимодействий. Квантовая механика представляет собой теоретическую основу, на которой строится современная теория атомов, атомных ядер, молекул и физических тел, а также элементарных частиц, из которых все это состоит. 7) Распределение электронов в атоме по уровням, подуровням и атомным орбиталям получило название электронной формулы элемента. Обычно электронная конфигурация приводится для основного состояния атома. В случае если один или несколько электронов находятся в возбужденном состоянии, то и электронная конфигурация будет характеризовать возбужденное состояние атома. При записи электронной конфигурации указывают цифрами главное квантовое число (n), буквами - подуровни(s, p, d, f), а степень буквенных обозначений подуровней обозначает число электронов в данном подуровне. Например, электронная конфигурация водорода-1s1, лития - 1s22s1, бора - 1s22s22p1, магния - 1s22s22p63s2. При составлении электронных конфигураций многоэлектронных атомов учитывают следующие принципы и правила. Принцип наименьшей энергии: устойчивому состоянию электрона в атоме соответствует наименьшее значение его энергии.Т.е. электроны заполняют орбитали в порядке повышения уровня энергии. Правило Клечковского: заполнение электронных орбиталей в атомах электронами происходит в порядке возрастания суммы квантовых чисел n + l. При равенстве этих сумм для 2-х орбиталей сначала заполняется орбиталь с меньшим значением n. Правило Клечковского является теоретическим обоснованием периодической системы. В соответствии с ним подуровни заполняются в следующей последовательности: 1s < 2s < 2p < 3s < 3p < 4s = 3d < 4p < 5s = 4d < 5p… Исключение составляют элементы, у которых наблюдается провал электронов, Cu, Aq, Cr, Mo, Pd, Pt. Принцип Паули (1925г.): в атоме не может быть 2-х электронов, имеющих одинаковый набор всех 4-х квантовых чисел. Отсюда следует, что на каждой орбитали может быть не более двух электронов - s2, p6, d10, f14. Правило Гунда: суммарное спиновое число электронов данного подуровня должно быть максимальным. Т.е. заполнение орбиталей подуровня начинается одиночными электронами с одинаковыми спинами. После того как одиночные электроны займут все орбитали в подуровне, заполняются орбитали вторыми электронами с противоположными спинами. 8) формулировка периодического закона
Д. И. Менделеева в свете теории строения атома.
Открытие периодического закона и разработка периодической системы химических элементов Д. И. Менделеевым явились вершиной развития химии в XIX веке. Обширная сумма знаний о свойствах 63 элементов, известных к тому времени, была приведена в стройный порядок.
Д. И. Менделеев считал, что основной характеристикой элементов являются их атомные веса, и в 1869 г. впервые сформулировал периодический закон.
Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
Весь ряд элементов, расположенных в порядке возрастания атомных масс, Менделеев разбил на периоды, внутри которых свойства элементов изменяются последовательно, разместив периоды так, чтобы выделить сходные элементы.
Однако, несмотря на огромную значимость такого вывода, периодический закон и система Менделеева представляли лишь гениальное обобщение фактов, а их физический смысл долгое время оставался непонятным. Лишь в результате развития физики XX века — открытия электрона, радиоактивности, разработки теории строения атома — молодой, талантливый английский физик Г. Мозле установил, что величина зарядов ядер атомов последовательно возрастает от элемента к элементу на единицу. Этим открытием Мозле подтвердил гениальную догадку Менделеева, который в трех местах периодической таблицы отошел от возрастающей последовательности атомных весов.
Так, при ее составлении Менделеев поставил 27Со перед 28Ni, 52Ti перед 5 J, 18Аг перед 19К, несмотря на то, что это противоречило формулировке периодического закона, то есть расположению элементов в порядке увеличения их атомных весов. Согласно закону Мозле заряды ядер данных элементов соответствовали положению их в таблице.В связи с открытием закона Мозле современная формулировка периодического закона следующая: 9) Так как электронное строение элементов изменяется периодически, то соответственно периодически изменяются и свойства элементов, определяемые их электронным строением, такие как энергия ионизации, сродство к электрону, электроотрицательность, размеры атомов окислительно-восстановительные и другие свойства. Энергия ионизации. Энергия, необходимая для удаления одного моля электронов от одного моля атомов какого либо элемента, называется первой энергией ионизации (потенциалом ионизации). В результате ионизации атомы превращаются в положительно заряженные ионы. Энергию ионизации выражают в кДж/моль, либо в эВ. Эта энергия характеризует восстановительную способность элемента. Она возрастает в периоде слева направо и в группе снизу вверх, что обусловлено увеличением размеров атомов и расстояния внешних подуровней от ядра. Наименьшие значения энергии ионизации имеют щелочные элементы, находящиеся в начале периода, наибольшими значениями энергии ионизации характеризуются благородные газы, находящиеся в конце периода. Сродство к электрону энергетический эффект присоединения моля электронов к молю нейтральных атомов. Единицы измерения кДж/моль или эВ. Наибольшие значения сродства к электрону имеют галогены фтор, кислород, сера. В периоде слева направо она увеличивается, а в группе снизу вверх растет. Электроотрицательность: характеристика способности атомов притягивать к себе электроны (ЭО). Она зависит от типа соединений, валентного состояния элемента. Существует несколько шкал электроотрицательности. Согласно Р.Малликену, ЭО равна полусумме энергии ионизации и энергии сродства к электрону. Наименьшие значения ЭО имеют s-элементы 1 группы, наибольшие значения – p-элементы 7 и 6 групп. 10.Причины возникновения связей в молекулах - ради устойчивости молекулы и кристалл в целом. Химическая связь определяется взаимодействием между заряженными частицами (ядрами и электронами) Виды химической связи: 1. Ковалентная 2. Ионная 3. Металлическая 4. Донорно – акцепторная Валентность. Опр: способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов. 11.Параметры химической связи: 1. Энергия связи. Химическая связь возникает лишь в том случае, если полная энергия взаимодействующих атомов уменьшается, т.е. при образовании связи должна всегда выделяться энергия 2. Длина связи. Она зависит от размеров электронных оболочек и степени их перекрывания. С уменьшением длины связи обычно растет энергия связи и устойчивость молекул. 3. Валентный угол – угол, образуемый линиями, проходящими через ядра атомов. 12.Ковалентная химическая связь. Опр:химическая связь, образованная направленными валентными электронными облаками. Свойства связи: 1. Насыщаемость- способность атомов образовывать ограниченное число ковалентных связей. 2. Направленность ковалентной связи определяет пространственную структуру молекул. 3. Полярность ковалентной связи. Если ковалентная связь образована одинаковыми атомами, то она неполярная. Если же один из атомов сильнее притягивает электроны, то электронная пара смещается в сторону этого атома и в этом случае возникает полярная ковалентная связь 13.Гибридизация атомных орбиталей-гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной молекулы нету с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам. 14.Ионная связь. Опр: очень прочная химическая связь, образующаяся между атомами с большой разностью (>1,5 по шкале Полинга) электроотрицательностей, при которой общая электронная пара переходит преимущественно к атому с большей электроотрицательностью. 15.Химическая термодинамика. Опр: раздел физической химии, изучающий процессы взаимодействия веществ методами термодинамики. Термодинамические параметры— физические величины, характеризующие состояние термодинамической системы: температура, давление, удельный объём, намагниченность, электрическая поляризация и др. Различают экстенсивные параметры состояния, пропорциональные массе системы:
объём, внутренняя энергия, энтропия, энтальпия, энергия Гиббса, энергия Гельмгольца (свободная энергия),
и интенсивные параметры состояния, не зависящие от массы системы:
давление, температура, концентрация, магнитная индукция и др.
Не все параметры состояния независимы, так что равновесное состояние системы можно однозначно определить, установив значения ограниченного числа параметров состояния. Внутренняя энергия принятое в физике сплошных сред, термодинамике и статистической физике название для той части полной энергии термодинамической системы, которая не зависит от выбора системы отсчета и которая в рамках рассматриваемой проблемы может изменяться. Или Внутренняя энергия – энергия покоя. Она складывается из теплового хаотического движения молекул, составляющих тело, потенциальной энергии их взаимного расположения, кинетической и потенциальной энергии электронов в атомах, нуклонов в ядрах и так далее. Энергия, которую получает или теряет тело в процессе теплообмена с окружающей средой, называется количеством теплоты́ или просто теплотой. Теплота— это одна из основных термодинамических величин в классической феноменологической термодинамике. Количество теплоты входит в стандартные математические формулировки первого и второго начал термодинамики. Работа– это способ передачи энергии, связанный с изменение внешних параметров системы. Тепловой эффект химической реакции:отнесенное к изменению химической переменной количество теплоты, полученное системой, в которой прошла химическая реакция. Энергетический эффект химического процесса возникает за счет изменения в системе внутренней энергии или энтальпии. 16.Первый закон термодинамики: В состоянии равновесия термодинамическая система характеризуется определенными значениями макроскопических параметров. Эти параметры связаны между собой уравнением состояния. Энтальпия: Энтальпия- это энергия присущая конкретной системе, находящейся в термодинамическом равновесии при константных параметрах (давление и энтропия). Изменение энтальпии экзо- и эндотермических реакций: Принято, что энтальпия экзотермической реакции отрицательна (DH<0), а энтальпия эндотермической реакции положительна (DH>0). 17.Закон Гесса — основной закон термохимии, который формулируется следующим образом: · Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания. Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данноехимическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы). Например, окислениеглюкозы в организме осуществляется по очень сложному многостадийному механизму, однако суммарный тепловой эффект всех стадий данного процесса равен теплоте сгорания глюкозы.
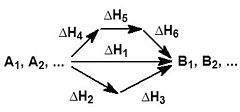
На рисунке приведено схематическое изображение некоторого обобщенного химического процесса превращения исходных веществ А1, А2… в продукты реакции В1, В2…, который может быть осуществлен различными путями в одну, две или три стадии, каждая из которых сопровождается тепловым эффектом ΔHi. Согласно закону Гесса, тепловые эффекты всех этих реакций связаны следующим соотношением:
Закон открыт русским химиком Г. И. Гессом в 1840 г.; он является частным случаем первого начала термодинамикиприменительно к химическим реакциям. Практическое значение закона Гесса состоит в том, что он позволяет рассчитывать тепловые эффекты самых разнообразных химических процессов; для этого обычно используют ряд следствий из него. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 (скорости света), импульс равен
(скорости света), импульс равен 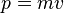 (где
(где 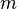 — масса частицы),
— масса частицы),