|
|
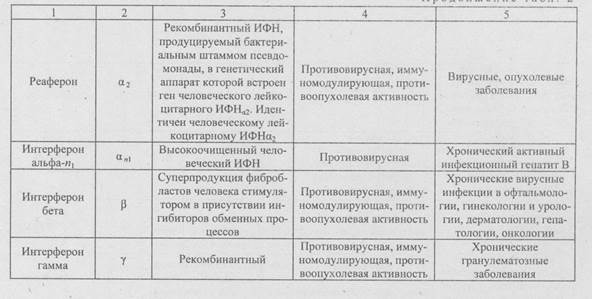
Сомототропный гормон (СТГ) или гормон роста человекаСТГ - пептидный гормон, состоящий из 191 аминокислоты, секре-тируется передней долей гипофиза. Впервые гормон был выделен и очищен в 1963 г. из гипофиза, полученного из трупного материала. Дефицит этого гормона приводит к гипофизарной карликовости, частота встречаемости которой оценивается от 7 до 10 случаев на миллион человек (среди детей западных стран она составляет 1 на 5000 человек). Гормон видоспецифичен и является единственным средством лечения детей, страдающих от его недостатка; внутримышечное введение СТГ 10 мг/кг в течение года по три инъекции в неделю, увеличивает рост в течение первого года лечения более чем на 6 см. Для достижения более ощутимых результатов введение гормона необходимо продолжать от возраста 4-5 лет до половой зрелости и даже далее. Из одного трупа удаётся получить 4-6 мг соматотропина в пересчете на конечный фармацевтический препарат. Общего количества фармацевтического препарата, выпускаемого компаниями крупных производителей СТГ, хватало для лечения лишь одной трети случаев гипофизарной карликовости в развитых странах; недостаток соматотропина оказался ещё более острым с учетом других случаев его применения (незаживающие переломы, ожоги, язвы, нару1 шение гемопоэза). К тому же возникли проблемы, связанные с гетерогенностью гормона, выделяемого из трупного материала. Несмотря на совершенствование выделения и очистки гормона, у 5% больных, получавших препарат, вырабатывались антитела, которые сводили на нет его биологическую активность. Кроме того, гипофизарный материал заражён нейро-токсическим вирусом с необычайно длительным инкубационным периодом, поэтому дети, получавшие СТГ, нуждались в многолетнем медицинском наблюдении. Вирус, содержавшийся в препаратах СТГ, нередко приводил к летальному исходу. С 1985 г. ВОЗ запрещено применение гормона, выделяемого из человеческих гипофизов. Рекомбинантный соматотропин, получивший название соматрем, стал вторым (после человеческого инсулина) биосинтетическим фармацевтическим препаратом. СТГ, биологически чистый и свободный от вирусных загрязнений, впервые был получен в 1980 г. фирмой «Genen-tech». Гормон, синтезированный в генетически сконструированных клетках кишечной палочки, отличается от гормона, выделенного из гипофиза, дополнительным остатком метионина на NН2-конце молекулы (гормон обладает биологической активностью нативного гормона и даже большим эффектом, чем гормон роста из гипофиза, по-видимому, по причине большей чистоты). У детей, страдающих гипофизарной карликовостью, зарегистрирован прирост 8-18 см в год, что несколько больше эффекта гормона, полученного из гипофиза. На первом этапе клонировали двунитевую ДНК-копию мРНК и расщеплением рестрикцион-ными эндонуклеазами получили последовательность, которая кодирует всю аминокислотную последовательность гормона, за исключением первых 23 аминокислот. Затем клонировали синтетический полипептид, соответствующий аминокислотам от 1-й до 23-й. Далее два фрагмента объединяли, затем «подстроили» к паре промоторов (промотор — специфическая последовательность в ДНК, необходимая для инициации транскрипции РНК-полимеразы) и участку связывания рибосом. Конечный выход гормона составил 2,4 мкг на 1 мл культуры Е. coli (100000 молекул гормона на клетку). СТГ, синтезированный в бактериях, обладал нужной м.м. и не связан с каким-либо бактериальным белком, от которого его необходимо было бы отщеплять. Изменяя аминокислотную последовательность СТГ, т.е. его первичную структуру, посредством модификации кодирующего его гена, в бактериальных клетках можно синтезировать аналоги гормона, очень важные для изучения активных участков молекулы (например, участков, которые стимулируют рост или оказывают действие на неоглюко-генез) и этиологии карликовости на молекулярном уровне. Используя методы рекомбинантных ДНК, можно синтезировать и другие факторы роста и факторы дифференцировки тканей, выделив вначале их мРНК, затем получив соответствующие гены. Это относится к соматомедину А, стимулирующему фиксацию серы в хряще, образование которого индуцируется соматотропином. В 1982 г. выделен и синтезирован полипептид, содержащий из 44 аминокислотных остатков, обладающий полной биологической активностью гипоталамического рилизинг-фактора соматотропина (СТГ-РФ). Введение СТГ-РФ способно компенсировать недостаток соматотропина. Применение СТГ-РФ возможно не только для лечения гипо-физарной карликовости, но и при некоторых формах диабета и для ускорения регенерации тканей у людей, получивших сильные ожоги. Эритропоэтин Эритропоэтин (греч. eritrhros - красный + poietikos - создающий, производящий; син.: эритро-лоэзстимулирующий фактор) - гормон гликопротеиновой природы, стимулирующий пролиферацию и диффе-ренцировку эритропоэтин-чувствительных клеток в морфологически распознаваемые эритробласты. Это полипептид, состоящий из 165 аминокислот с м.м. 30400. Эритропоэтин стимулирует пролиферацию и дифференцировку клеток эритроидного ростка, действуя на специфические рецепторы эритропоэтина, которые имеются на предшественниках эритроцитов в костном мозге. Эндогенный эритропоэтин выделяется в почках в ответ на тканевую гипоксию. При анемии индукция эритропоэтина повышена, что стимулирует образование эритроцитов в костном мозге и приводит к коррекции анемии. Эритропоэтин показан больным с почечной недостаточностью и выраженной анемией. Он повышает уровень гемоглобина и обычно снимает необходимость переливания крови у этих пациентов; эритропоэтин полезен при СПИДе и раке. Эритропоэтин выделен первым из всех гемопоэтических факторов (впервые получен из мочи больных тяжелой анемией). Получение значимых количеств эритропоэтина человека из природных источников практически невозможно из-за низкого его содержания в сырье. С использованием генно-инженерной технологии в культуре клеток млекопитающих (штамм СНО) получают рекомбинантный человеческий эри-тропоэтин. Производство препарата основано на комбинации иммуно-аффинной и ионно-обменной хроматографии и позволяет получать практически гомогенный, мономерный, полностью активный белок, не содержащий значимых примесей. Уже много лет получаемый по новой технологии эритропоэтин является ведущим продуктом предприятия Amgen, Калифорния (США). Годовой оборот от его производства составляет более 3 млрд долларов. Эритропоэтин принадлежит к четырем генно-инженерным препаратам, производимым в России. В частности, НПО «Микроген» выпускает «Эритростим», представляющий высокоочищенный (99,5 %) рекомбинантный эритропоэтин человека с сывороточным альбумином в виде раствора на изотоническом нитратном буфере. Вакцины Вирусы — облигатные (безусловные) внутриклеточные паразиты, чья репликация полностью зависит от процессов синтеза ДНК, РНК и белков в клетке хозяина. Репликация вирусов включает несколько этапов: адсорбция и проникновение в клетку; синтез ранних, неструктурных белков, например, полимераз, нуклеиновых кислот; - синтез РНК или ДНК; синтез конечных структурных белков; сборка (созревание) вирусных частиц и их выход из клетки. При многих вирусных инфекциях репликация вируса достигает максимума во время появления первых клинических признаков заболевания или даже ранее. Формированию у реципиента иммунитета к патогенным микроорганизмам способствует вакцинация. Антитела, вырабатываемые в ответ на введение вакцины в организм, запускают иммунный ответ - вырабатываются антитела, которые при последующей инфекции блокируют пролиферацию патогенного микроорганизма и не позволяют развиться заболеванию. Эффект вакцинации был открыт более 200 лет назад (1796 г.) врачом Эдвардом Дженнером, доказавшим, что человек, перенесший коровью оспу, не очень тяжелую болезнь крупного рогатого скота, становится невосприимчив к оспе натуральной. Натуральная оспа - высоко-контагиозное (заразное) заболевание, с высокой смертностью; даже, если больной не погибает, у него нередко возникают различные уродства, психические расстройства, слепота. Э. Дженнер публично провел прививку коровьей оспы 8-летнему мальчику Джеймсу Фиппсу, использовав для этого экссудат из пустулы больной коровьей оспой, а затем, через определенное время, дважды инфицировал ребенка гноем из пустулы больного натуральной оспой. Все проявления заболевания ограни- • чились покраснением в месте прививки, исчезнувшим через несколько дней. Начиная с первой вакцины, созданной Э. Дженнером, большинство человеческих противовирусных вакцин созданы на основе убитых (инактивированных) патогенных микроорганизмов или живых, но не вирулентных (аттенуированных) штаммов. Этот подход достаточно эффективен и предотвращает распространение многих вирусных инфекций, однако его применение ограничено рядом причин: невозможностью культивирования всех патогенных микроорганизмов; потенциальной опасностью в работе с патогенными микроорганизмами и вирусами; возможностью ревертировать (возвращаться к исходному вирулентному штамму) аттенуированных штаммов (инактивация часто бывает неполной); высокой стоимостью производства традиционных вакцин (титр вирусов животных и человека в культуре и скорость их размножения, как правило, невысоки). Технология рекомбинантных ДНК позволяет создавать новое поколение вакцин более безопасных и эффективных, менее дорогих, не имеющих ограничений в применении. При этом используют разные подходы: 1.Патогенный микроорганизм модифицируют, делегируя (убирая) гены, ответственные за вирулентность, при этом сохраняется способность штамма вызывать иммунный ответ. Получаются живые вакцины, содержащие непатогенные микроорганизмы, которые не могут ревертировать и становиться патогенными. 2. Гены или их сегменты, кодирующие основные антигенные детерминанты (белки) патогенных микроорганизмов, экспрессиру-ют в альтернативном хозяине, например Е. coli, получают нужный продукт в большом количестве и используют его как вакцину. Такие вакцины, содержащие лишь отдельные компоненты патогенного микроорганизма, называют субъединичными вакцинами. Достоинства субъединичных вакцин состоят в том, что препарат, содержащий очищенный иммуногенный белок, стабилен и безопасен, его химические свойства известны, в нем отсутствуют дополнительные белки и нуклеиновые кислоты, которые могут быть причиной нежелательных побочных эффектов в организме-хозяине. Недостатки субъединичных вакцин — очистка специфического белка высока по стоимости; его конформация после выделения может отличаться от той, которую он имеет in situ (т.е. в составе вирусного капсида или оболочки), что может повлечь изменение его антигенных свойств. 3. Клонированные гены, кодирующие основные антигенные детерминанты патогенного организма, встраивают в геном непатогенного носителя (обычно вируса) и получают живую безопасную, не содержащую болезнетворных микроорганизмов вакцину. Живые вакцины, как правило, более эффективны, чем неживые или субъединичные. Одним из новых направлений создания рекомбинантных вакцин является разработка ДНК-вакцин (так называемых генных, полинуклео-тидных вакцин, вакцин из нуклеиновых кислот). Принцип применения ДНК-вакцин заключается в том, что в организм пациента вводят молекулу ДНК, содержащую гены, кодирующие иммуногенные белки патогенного организма и генетические элементы, которые необходимы для экспрессии этого гена в клетках эукариотов (человека). В качестве продуцентов таких генов используют бактериальные клетки, содержащие рекомбинантные плазмиды с соотвествующими генами. После получения достаточной биомассы (количества копий) плазмидную ДНК выделяют из бактерий, очищают от других молекул ДНК и примесей. Полученную ДНК-вакцину вводят парентерально, при этом большая ее часть поступает в межклеточное пространство, после чего включается в клетки. Противогерпетические вакцины. Вирус простого герпеса (HSV. Herpes simplex virus) вызывает инфекционное заболевание генерализованного или местного характера (характеризуется преимущественно поражением кожи, слизистых оболочек, нервной системы и хроническим рецидивирующим течением, урогенитальными инфекциями, тяжелым поражением глаз, энцефалитом и т.д.). Кроме того, он является онкогенным, поэтому вакцинация убитым или аттенуированным вирусом сопряжена с определенным риском развития рака. Для защиты от HSV-инфекции используют неонкогенную субъединенную вакцину. Для создания любой субъединенной вакцины прежде всего идентифицируют те компоненты патогенного микроорганизма, которые индуцируют выработку антител. В случае HSV-типа таким компонентом является гликопротеин Д-оболочки (gД\). В ответ на введение этого гли-копротеина мышам у них вырабатываются антитела, нейтрализующие интактный HSV. Ген gjД HSV-1 был изолирован, клонирован в одном из экспрессирующих векторов в клетках млекопитающих и введен в яйцеклетки китайского хомячка (СНО), в которых, в отличие от Е. coli, происходит гликолизирование чужеродных белков. Полноразмерный ген gД кодирует белок, в норме связывающийся с мембраной клетки млекопитающего. Затем модифицированным геном трансформировали СНО-клетки, которые гликозилировали белковый продукт и секретиро-вали его во внешнюю среду, так как он не мог встраиваться в клеточную мембрану. Антитела, вырабатываемые в ответ на введение модифицированного белка gД, эффективны в отношении вируса простого герпеса. Противосальмонеллезные вакцины. Разные штаммы Salmonella вызывают острые кишечные инфекции, постнатальную (послеродовую) инфекцию, брюшной тиф, пищевую токсикоинфекцию. Для профилактики всех этих заболеваний у овец, КРС, цыплят и человека эффективные пероральные вакцины созданы методом двойной делеции. Такой способ получения непатогенных штаммов, пригодных для создания на их основе живых вакцин, состоит в удалении из генома патогенных бактерий хромосомных областей, отвечающих за независимые жизненноважные функции. Лучше делетировать по крайней мере две такие области, так как вероятность их одновременного восстановления очень мала. Штамм с двойной делецией обладает ограниченной пролиферативной способностью и сниженной патогенностью, но обеспечивает выработку иммунного ответа. Штаммы Salmonella с двойной делецией вызывают легкую форму инфекции и обладают в 100 тыс. раз меньшей вирулентностью. 6.7. Цитокины Цитокины - большая гетерогенная группа белков с различными функциями, синтезируемая лимфоретикулярными клетками. Цитокины участвуют во многих видах взаимодействий, обеспечивающих функционирование иммунной системы и контроль гемопоэза. Первая группа цитокинов была представлена интерферонами (ИФН), часть цитокй-нов была классифицирована как интерлейкины (ИЛ), пронумерованные в порядке их обнаружения. ИФН - это группа эндогенных гликопротеидов с м.м. около 3000, которые оказывают неспецифическое противовирусное действие, влияя на клеточные метаболические процессы синтеза РНК и белка. Первоначально было установлено, что ИФН вырабатывают клетки, инфицированные вирусами (тип I); в дальнейшем - что ИФН вырабатывают также лимфоциты в ходе иммунной реакции (тип II). Для получения больших количеств ИФН используют шестидневные однослойные культуры клеток куриного эмбриона или культивируемые лейкоциты крови человека, зараженные определенным видом вируса. Иными словами, для получения ИФН создают определенную систему вирус-клетка. Из клетки человека изолирован ген, ответственный за биосинтез ИФН. Экзогенный человеческий ИФН получают, используя технологию рекомбинантных ДНК. Процедура выделения кДНК ИФН-ов состоит в следующем: Из лейкоцитов человека выделяют мРНК, фракционируют,ее по размерам, проводят обратную транскрипцию, встраивают в сайт модифицированной плазмиды. Полученным продуктом трансформируют Е. coli; образовавшиеся клоны подразделяют на группы, которые идентифицируют. - , Каждую группу клонов гибридизируют с ИФН - мРНК. Из образовавшихся гибридов, содержащих кДНК и кРНК, выделяют мРНК, проводят ее трансляцию в системе синтеза белка. Определяют интерферонную противовирусную активность каждой смеси, полученной в результате трансляции. Группы, проявившие интерферонную активность, содержат клон с кДНК, гибридизировавшийся с ИФН - мРНК; повторно идентифицируют клон, содержащий полноразмерную ИФН - кДНК человека. ИФН проявляют некоторые виды активности как лимфокины и иммуномодуляторы. ИФН I типа, действующие преимущественно как ингибиторы репликации вирусов в клетке, реализуют свой эффект, стимулируя выработку рибосомами клеток хозяина клеточных ферментов, которые тормозят продукцию вирусов, нарушая трансляцию вирусной мРНК и синтез вирусных белков. ИФН вырабатывают большинство видов животных, но проявление их активности видоспецифично, т.е. они действуют только у того вида животных, в которых вырабатываются. Описаны три основных человеческих ИФН: ИФН-а, представляющий собой фибробластный ИФН типа I; ИФН-B - человеческий фибробластный ИФН типа I; ИФН-у - человеческий иммунный ИФН типа И. ИФН, вырабатываемые клетками любого типа, различают по химическому строению и виду активности (табл. 2). ИФН являются одним из основных эндогенных факторов, препятствующих поражению организма вирусной инфекцией. ИФН вызывают индукцию трех ферментов: протеинкиназы, нарушающей начальный этап построения пептидной цепи; олигоизоаденилат синтетазы, активирующей РНК-азу, которая разрушает вирусную РНК; фосфодиэстеразы, разрушающей конечные нуклеотиды тРНК, что приводит к нарушению элонгации пептида. С учетом антивирусного и иммуномоделирующего эффектов ИФН в НПО «Биомед» предложены и успешно апробированы суппозитории с ИФНаn и пробиотиками при терапии дисбактериозов вирусной и бактериальной этиологии, кандидозов; в гинекологической практике для лечения эндометритов, кольпитов, вагинитов и гинекологического герпеса.. Побочные эффекты ИФН включают лихорадку, утомляемость, головные боли, слабость, миалгии, анемии, желудочно-кишечные и сер-дечно-сосудичтые нарушения. Развитие методов клонирования генов в значительной мере облегчило продукцию высокоочищенных цитокинов всех типов и идентификацию большинства интерлейкинов (ИЛ). Специфический ген человеческого ИЛ с присоединенным к нему сегментом ДНК, кодирующим маркерный пептид (участок гибридной белковой молекулы, облегчающий идентификацию и очистку белка), переносят в микробные клетки-продуценты, где экспрессируется химерный белок (продукт клонированного гена, защищенный одной или несколькими аминокислотами от расщепления протеиназами клетки-хозяина). Конструирование рекомбинантных молекул ИЛ осуществляется набором специфичных ферментов. Маркерный пептид, входящий в состав химернвго белка, очищают иммуноафинной хроматографией.
Главным из цитокинов являются ИФНу и ИЛ-2. ИФНу - ключевой медиатор активации системы естественной цитотоксичности, регулирует процесс дифференцировки естественных киллерных клеток и их ци-тотоксическое взаимодействие с клетками-мишенями, стимулирует ци-тотоксические и регуляторные функции макрофагов, активирует цито-токсические лимфоциты. Под действием ИФНу повышается продукция цитокинов, таких, как ИЛ-1, ИЛ-2, ИЛ-12, ИФНр, и фактора некроза опухолей-а. ИЛ реализуют эффект через рецепторы на поверхности соответствующих клеток-мишеней. Многие ИЛ проходят стадию клинического изучения, другие — нашли разнообразное применение в лечении инфекций, воспалительных, аутоиммунных и неопластических расстройств. Так, ИЛ-1 показан для лечения воспалений и септического шока, ИЛ-2 включен в схемы лечения имуногенных опухолей (меланомы, почечноклеточного рака, рака мочевого пузыря).
Тест-контроль к главе 6 Выберите правильные, ответы: 1.Антигенсвязывающая активность антитела определяется: А - Fab-фрагментом (Fv-фрагментом); Б — вариабельными концами Н- и L-цепей; В - константной областью или доменом; Г — всей молекулой нативного антитела; Д - количеством дисульфидных мостиков между L- и Н-цепями. 2. Присоединение молекулы ЛВ к моноклональным антителам или их Fv-фрагментам используют для: А - повышения стабильности ЛВ; Б - целенаправленной доставки ЛВ к месту его действия; В - расширения фармакологического спектра действия ЛВ; Г - снижения стоимости лекарственного препарата; Д - получения пролекарства. 3. Механизм получения пролекарства на основе моноклональных антител заключается в: А — использовании лекарства в неактивной форме; Б — использовании лекарства в активной форме; В - связывании лекарства с ферментом; Г - заключении антитела в липосомы; Д - связывании фермента с моноклональным антителом. 4.Активация лекарственного средства у клетки-мишени происходит За счет: А - введения активаторов связывания; Б - локального повышения температуры вблизи клетки-мишени; В - связывания фермента с моноклональным антителом; Г - антигенной специфичности моноклонального антитела; Д - связывания лекарственного вещества с ферментом. 5.Источником препарата урокиназы является: А — изолированные каллусные культуры; Б - культуры клеток эмбриона почки человека; В - донорская кровь; Г - клонированная Е. coli; Д - связывания лекарственного вещества с ферментом. 5. Стрептокиназа: А - производится из донорской крови; Б - производится из р-гемолитического стрептококка группы С; В - является прямым тромболитиком; Г - является непрямым тромболитиком; Д - проникает внутрь тромба; Е — не проникает внутрь тромба. 6. Отличия фармакотерапевтических свойств урокиназы от стрепто-киназы заключаются в том, что: А - более медленно наступает фибиринолитический эффект; Б - более быстро наступает фибиринолитический эффект; В - не обладает выраженными антигенными свойствами; Г - обладает выраженными антигенными свойствами; Д - активирует эндо- и экзотромболиз. 7. Рекомбинантный гибрид белка С - это: А - антикоагулянт; Б - витамин-К-зависимый ингибитор свертывающей системы; В - провитамин аскорбиновой кислоты; Г — фибринолитик; Д — белок крови человека. 8.Промышленным источником получения аминокислот являются: А - низкомолекулярные азотистые соединения; Б - продукты метаболизма неспорообразующих грамположитель- ных почвенных бактерий; В - гидролизат белка; Г - торф; Д - белок крови человека. 9. Промышленный синтез аскорбиновой кислоты осуществляется: А - химическим синтезом; Б - продуктами метаболизма неспорообразующих грамположитель- ных почвенных бактерий; В - гидролизатом белка; Г - торфом; Д - белком крови человека. 10. Биотехнологический процесс получения аскорбиновой кислоты включает: А - культивирование трансформированных клеток Erwinica herbi-cola; Б - микробиологическое расщепление целлюлозы; В - совместное культивирование микроорганизмов Corynebacterium и Erwinica herbicola; Г - последовательное культивирование микроорганизмов Corynebacterium и Erwinica herbicola; Д - культивирование штамма Streptococcus equisimilis. 11.Производство инсулина, идентичного человеческому, осуществляется: А - высокоэффективной очисткой инсулина животного происхождения; Б - превращением свиного инсулина замещением аланина на треонин; В — химическим синтезом; Г - генно-инженерным методом; Д - любым из перечисленных методов. 12. Процесс получения генно-инженерного инсулина включает: А - выращивание биомассы рекомбинантного штамма Е. coli; Б - выделение препроинсулина из культуральной массы; В - отщепление лидирующего полипептида; Г — восстановительное замыканием трёх дисульфидных связей и ферментативное вычленение связывающего С-пептида; Д - хроматографическую очистку инсулина. 13.Гетерогенность человеческих генно-инженерных препаратов инсулина связана с: А — недостаточной степенью очистки; Б - различием аминокислотного состава полипептида; В - нестабильностью штамма-продуцента; Г - наличием постороннего генетического материала в препарате; Д - неиндентичностью экспрессируемого гена. 14. Отличия препарата генно-инженерного соматотропина от гормона, выделяемого из гипофиза, заключаются в: А — разной степени чистоты; Б — разном аминокислотном составе; В — отсутствии нейротоксичных вирусов; Г - более выраженной токсичности; Д - более на единицу массы сырья высоком выходе. 15. Промышленным источником препаратов эритропоэтина являются: А — моча больных анемией; Б - донорская кровь животных, больных анемией; В - культура клеток млекопитающих; Г - культура растительных клеток; Д - почки животных. 16. Применение человеческих противовирусных вакцин ограничено: А — невозможностью культивирования всех патогенных микроорганизмов; Б - потенциальной опасностью в работе с патогенными микроорганизмами и вирусами; В — возможностью ревертировать (возвращаться к исходному вирулентному штамму) аттенуированных штаммов; Г - высокой стоимостью производства традиционных вакцин; Д - отсутствием реактивности иммунной системы на некоторые вирусы. 17. Субъединичные вакцины - это: А - вакцины против одного возбудителя; Б - антигенные детерминанты (белки); В - генетически модифицированный патогенный микроорганизм; Г - непатогенные микроорганизмы с клонированным геном, кодирующим антигенные детерминанты патогенного организма; Д - ДНК-вакцины. 18. Недостатки субъединичных вакцин: А - низкая эффективность; Б - высокая стоимость; В - риск изменения конформации белка (антигенных свойств); Г — способность проявлять вирулентность; Д - более выраженные побочные реакции в сравнении с классическими вакцинами. 19. Пероральные вакцины, созданные методом двойной делеции, это: А - мертвые вакцины, прошедшие двойную стерилизацию; Б - живые вакцины на основе патогенных бактерий с удаленными из генома областями, отвечающими за независимые жизненно важные функции; В - живые вакцины на основе патогенных бактерий с удаленными из генома областями, отвечающими за вирулентность; Г - вакцины с ограниченной пролиферативной способностью и сниженной патогенностью; Д - вакцины против двух возбудителей (видов инфекций). 20.Большие количества ИФН получают из: А — шестидневных однослойных культур клеток куриного эмбриона; Б - культивируемых лейкоцитов крови человека, зараженных определенным видом вируса; В — культивируемых лимфоцитов крови человека, зараженных определенным видом вируса; Г - культивируемых фибробластов крови человека, зараженных определенным видом вируса; Д - генно-инженерным путем.
Глава 7. АНТИБИОТИКИ Антибиотики - специфические продукты жизнедеятельности различных групп микроорганизмов, низших и высших растений и животных или их модификаций, обладающие высокой физиологической активностью в отношении определённых групп микроорганизмов или злокачественных опухолей, избирательно задерживающие их рост или подавляющие развитие. Образование антибиотиков - наследственно закреплённая особенность метаболизма организмов. Это проявляется в том, что каждый вид (или даже штамм) способен образовывать один или несколько определенных, строго специфичных для него антибиотических веществ. Вместе с тем одинаковые антибиотики могут образовываться несколькими видами организмов (это свидетельство того, что данные микроорганизмы имеют общего предка). Образование антибиотика обусловлено определённым характером обмена веществ, возникающим и закреплённым в процессе эволюции организма. Эволюционное значение антибиотиков подчёркивается тем, что в антибиотикообразование может быть включено около 1% генов продуцента (род Streptomyces) и эта часть ДНК, несмотря на энергетические затраты при её репликации, не теряется во время селекции в естественных условиях. Образование антибиотиков - фактор биологический, имеющий адаптационное значение. Для продуцента способность образовывать антибиотики важна не постоянно, а лишь в неблагоприятных условиях, например, при истощении среды питательными компонентами, при контакте со специфическими продуктами жизнедеятельности другого организма. Формы взаимодействие между организмами весьма разнообразны -от мирного сожительства до явного антагонизма. Типы связей внутри микробиологических сообществ подразделяют на трофические и метаболические. Трофические связи характерны для метабиоза (последовательное использование субстрата), когда продуты жизнедеятельности одного микроорганизма, содержащие значительное количество энергии, потребляют другие виды микроорганизмов в качестве питательного материала. Метаболические связи выстраиваются, когда одни микроорганизмы могут потреблять отдельные продукты метаболизма других микроорганизмов или продукты метаболизма являются их ингибиторами. Тип связи определяет специфику взаимодействия организмов. Сим-биотические взаимоотношения характеризуются тем, что различные виды микроорганизмов создают для себя взаимовыгодные условия. Например, совместное развитие аэробных и анаэробных микроорганизмов: развиваясь в аэробных условиях, микробы поглощают кислород, создавая благоприятные условия для развития анаэробов. Паразитизм ~ форма взаимоотношений, при которой некоторые микробы развиваются за счет веществ клетки других организмов, например бактерии. Паразиты бывают внеклеточные (риккетсии) и внутриклеточные (вирусы). Хищничество имеет место, когда некоторые микробы поглощают клетки организмов других видов, используя их в качестве источника питания (преимущественно продукты лизиса живых клеток других бактерий). К числу микроорганизмов-хищников относятся, главным образом, миксоформы (миксобактерии, миксоамебы, миксомицеты). Антагонизм — это условия, при которых один вид микроорганизмов угнетает или полностью подавляет рост и развитие других видов. Явление антагонизма широко распространено среди бактерий, актиномицетов, грибов и других микроорганизмов. Образование антибиотических веществ -специфическая особенность вида или даже штамма микроорганизмов, возникшая в результате их эволюционного развития как одна из приспособительных особенностей. В естественных условиях четко ограниченных форм взаимоотношений не наблюдается. В процессе эволюции на разных этапах роста организмов и в зависимости от условий их развития один тип взаимодействия может смениться другим. Так, ряд бактерий (Е. coli, В. subtilis, В. cereus и др.) образуют фермент пенициллиназу, разрушающий пенициллин, выделяемый Penicillium notatum, P. chrisogenum и мицелиаль-ными грибами других видов. Антибиотики - первые лекарственные средства, полученные биотехнологическим способом. С антибиотиками человечество сталкивается с древних времён. Уже в Библии упоминается использование травы иссоп для лечения кожных заболеваний. Эта трава, как известно, поражается плесенью рода Penicillium или Aspergillus и может быть насыщена метаболитами грибов антибиотического характера. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|