
|
|
Поступление ХС а клетку в составе ЛПНПМеханизм транспорта ХС в составе ЛПНП посредством рецептор-опосредуемого эндоцитоза известен благодаря блестящим работам М. Вгown и J. Goldstein, за которые они в 1985 г. получили Нобелевскую премию. В 1973-1975 гг. М. Вгown и J. Goldstein показали, что фибробласты кожи, гладкомышечные клетки (ГМК) артерий и лимфоциты человека имеют на своей мембране специфические рецепторы белковой природы, способные связывать ЛПНП. Процесс взаимодействия ЛПНП-частицы с рецептором характеризуется высокой чувствительностью и специфичностью. Один рецептор связывает одну частицу ЛПНП, а общее число рецепторов на одной клетке колеблется от 15 до 70 тысяч. Взаимодействие ЛПНП с рецептором происходит в области специальных образований мембраны, получивших название окаймленных ямок. В этих ямках в присутствии ЛПНП происходит концентрирование рецепторов с участием мембранного белка клатрина. После связывания ЛПНП с рецепторами окаймленные ямки впячиваются внутрь клетки и отрываются от мембраны, образуя эндоцитозные везикулы. В результате слияния везикул с внутриклеточными гладкими везикулами образуются эндосомы, в которых лиганд-рецепторный комплекс диссоциирует. В дальнейшем эндосомы, поглотившие ЛПНП-частицы, сливаются с лизосомами, где и происходит деградация ЛПНП. Освободившиеся рецепторы возвращаются и вновь встраиваются в плазматическую мембрану. Время рециклизации рецептора - около 20 минут, период
жизни - 1-2 суток. За это время рецептор совершает до 150 циклов, не подвергаясь деградации. Рис. 2. Структура частицы ЛПНП. Центральное ядро частицы содержит примерно 1500 молекул ЭХС И 300 молекул триглицеридов (ТГ) (на рисунке не показаны). Наружная оболочка содержит около 800 молекул фосфолипидов (ФЛ), Молекул свободного ХС и одну большую молекулу апопротенна В-100 (лиганда для апо-В,Е-рецептора). (По М. Вгown и J. Goldstein 1984). Структура ЛПНП-рецептора К настоящему времени структура ЛПНП-рецептора (апо- В, Е-рецептора) достаточно хорошо изучена. Лиганды данного типа рецепторов - апопротеины В и Е ЛПНП. (см. рис. 2). Рецептор представляет собой одноцепочечный гликопротеид с ММ 164 кДа; изоэлектрическая точка изолированного рецептора равна 4,6, что свидетельствует о большой концентрации отрицательных зарядов в его молекуле. Белковая часть рецептора синтезируется первоначально в эндоплазматической сети как предшественник, который затем превращается в зрелую форму в аппарате Гольджи, присоединяя сиаловую кислоту и галактозу. В целом рецептор состоит из 839 аминокислот (ак), не считая сигнального гидрофобного участка из 21 ак на аминотерминальном конце, который отщепляется от основной цепи при встраивании рецептора в мембрану и не присутствует в его зрелой форме.
В рецепторе различают 5 структурных доменов (рис. 3), имеющих различный аминокислотный состав и выполняющих различные функции.
Наружный участок или первый домен(292 ак со стороны аминотерминапьного конца) выполняет функцию святи с лиганлом.Особенность этого домена в его насыщенности цистеином. В пределах этого участка различают 7 гомологичных повторов, каждый из которых содержит по 6 цистеиновых остатков, соединенных между собой дисульфиднымн связями. На С-конце каждого повтора содержится высококонсервативная аминокислотная последовательность, обогащенная отрицательно заряженными аминокислотами. Наибольшей консервативностью отличается триплет Ser-Аsр-Glu, Эта последовательность, по мнению ряда авторов, имеет ведущее значение для связывания лиганда (апо-В, Е), несущего на поверхности положительный заряд за счет большого числа аргининовых и лизиновых остатков. Второй домен (400 ак) содержит три цистеинбогатых повтора. По структуре он близок эпидермальному фактору роста (ЭФР). Этот домен необходим для придания правильной пространственной ориентации лнганд-связывающему участку рецептора. Третий ломеи (58 ак). На этом участке происходит гликозилирование рецептора после его транспорта к наружной мембране. Четвертый домен (22 ак) осуществляет фиксацию рецептора к мембране. Последний, пятый домен (50 ак) приходится на С-концевую часть и локализован на цитоплазматнческой поверхности мембраны. Этот домен обеспечивает направленый внутриклеточный транспорт рецептора, связавшего ЛП-частицу. Он содержит высококонсерватнвную последовательность Аsn-Рго-Туr, которая служит сигналом для кластеризации молекул рецептора в области окаймленных ямок и их последующего эндоцитоза.
Функции ЛПНП-рецептора: • узнавание и высокоаффинное связывание ЛПНП; • упаковка лиганд-рецепторных комплексов в везикулы; • направленный транспорт везикул к лизосомам (т.е. функция вектора); • обратный транспорт и встраивание в мембрану. Взаимодействие ЛПНП с апо-В, Е-рецептором Рецепторный захват и последующий лизосомальный гидролиз ЛПНП приводит к распаду всех его составляющих. ЭХС ЛПНП (холестерил-линолеат) под действием лизосомальных гидролаз расщепляется до свободного ХС и жирных кислот. В отличие от других компонентов ЛНПН (белка, ФЛ или ТГ), выполняющих пластическую и энергетическую функции, свободный ХС оказывает на клетку многостороннее регуляторное влияние (см. рис. 4), в частности: 1. угнетается активность ГМГ-КоА-редуктазы (т.е. тормозится синтез 2. повышается активность ацил-КоА-холестерин-ацилтрансферазы
14 3. подавляется синтез новых молекул ЛПНП-рецептора, и, таким обратом, снижается рецепторный захват других частиц ЛНПН и дальнейшее поступление ХС в клетку. Предполагается, что свободный ХС или его оксипроизводные действуют непосредственно на участки ДНК, ответственные за синтез соответствующих ферментов. Таким образом, все эти процессы, развивающиеся в результате рецепторного захвата ЛПНП, осуществляют весьма тонкую и точную регуляцию постоянства содержания ХС в клетке. Благодаря механизму отрицательной обратной связи они обеспечивают поддержание баланса между внутриклеточным синтезом ХС и поступлением ХС извне. Так, избыточное поступление ХС в составе ЛПНП тормозит синтез собственного стерина, а в случае уменьшения доставки ХС внутриклеточный синтез ХС значительно активизируется. Захват ЛПНП при участии ЛПНП-рецептора типичен для клеток паренхиматозного и соединительнотканного типа. По подсчетам М. Вгown и J. Goldstein путем рецептор-опосредуемого захвата у здорового человека эа сутки из плазмы крови удаляется около 1 г ХС ЛПНП.
Необходимо подчеркнуть, что рецептор-опосредуемый эндоцитоз ЛПНП обеспечивает не только внутриклеточный баланс ХС, но и поддержание нормального уровня ХС и ЛПНП в крови, препятствуя тем самым развитию атеросклероза. Рис. 4. Схема охвата и деградации ЛПНП в фибробластах с участием ЛПНП-реценторов(По М. Вгown и J. Goldstein. 1984). 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
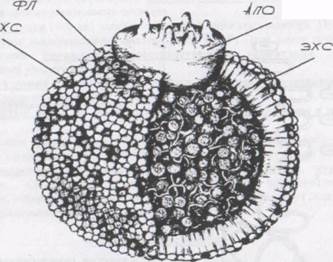
 Рис. 3. Структура апо-В, Е-рецептора (По М. Вгown и J. Goldstein, 1984).
Рис. 3. Структура апо-В, Е-рецептора (По М. Вгown и J. Goldstein, 1984).