|
|
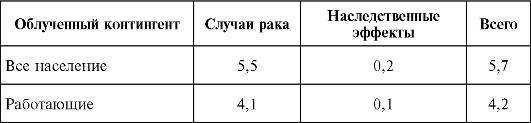
Количественная оценка риска стохастических эффектов облучения. Модели абсолютного и относительного рискаПодходя к проблеме количественной оценки последствий облучения в малых дозах на основе рабочей гипотезы о беспоро- говом действии ионизирующих излучений, приведем следующий вывод МКРЗ: «Теоретическое рассмотрение, экспериментальные результаты, полученные на животных и других биологических организмах, и даже некоторый ограниченный опыт, накопленный в наблюдениях над человеком, позволяют предположить, что индуцирование рака при малых дозах и мощностях дозы должно быть меньше, чем наблюдаемое при больших дозах и мощностях доз». Для того чтобы количественно отразить это обстоятельство (что частично достигается путем использования математических моделей доза-эффект), МКРЗ предложила для целей радиационной защиты (регламентации пределов доз облучения) использовать коэффициент, учитывающий эффективность дозы и мощность дозы (КЭДМД). По оценкам различных ученых, КЭДМД может коле- баться в широких пределах - от 2 до 10. МКРЗ решила для целей радиационной безопасности на современном этапе использовать значение КЭДМД, равное 2, осознавая вместе с тем, что этот выбор до некоторой степени произволен и, возможно, консервативен. Данная рекомендация может измениться, если в будущем станет известна новая, более определенная информация. Некоторые ученые считают, что использование численного значения коэффициента 2 приводит к завышению реальных рисков облучения в малых дозах в 2-5 раз. Следующая проблема состоит в оценке числа стохастических эффектов, которые еще не появились в изучаемой группе облучен- ных людей. Для некоторых видов рака, в частности лейкемии, эта проблема разрешается, поскольку частота возникновения новых случаев заболевания убывает или же близка к ожидаемой частоте в соответствующей контрольной группе людей. Обусловлено это, в частности, относительно коротким латентным периодом реали- зации данной формы заболеваний у человека после облучения: минимальный латентный период составляет 2-3 года, а избыточный выход этих заболеваний наиболее велик в интервале 7-10 лет после облучения. Для большинства видов солидных раков, для которых характерен существенно больший минимальный латент- ный период (~10 лет), а средний латентный период достигает 20- 25 лет, избыточная смертность имеет иное распределение во времени, близкое к естественной смертности от рака того же вида. В настоящее время для прогнозирования рисков ожидаемых канцерогенных эффектов по окончании их латентного периода и пожизненного риска этих стохастических эффектов в целом используют в основном две модели прогноза. Это так называемая модель абсолютного (аддитивного) риска и модель относительного (мультипликативного) риска. Модель абсолютного риска основывается на положении, что риск избыточных случаев рака не зависит от естественной частоты данного вида злокачественных опухолей. Под термином «избыточный» здесь и в дальнейшем подразумевается избыток неоплазм, обусловленных облучением или связанных с ним. В модели аддитивного риска проявление избыточного риска в облученной популяции начинается спустя некоторый период после облучения и существует как постоянная величина в последующем времени. Абсолютный риск определяется как число избыточных случаев рака на человека на единицу дозы и единицу времени. Радиогенный избыток раков здесь поделен на число облученных людей, среднее число лет на- блюдения за ними и среднюю величину дозы их облучения. Таким образом, абсолютный риск может быть выражен в виде годового или пожизненного абсолютного риска. По аддитивной модели абсолютный риск выражается как число избыточных случаев рака на 1 млн человек на 1 Зв (чел-Зв). В этой модели для определения риска возраст человека под наблюдением некритичен, если пройден (завершен) латентный период выхода опухолей. В то же время очевидно, что пожизненный абсолютный риск зависит от возраста на момент облучения. В мультипликативной модели избыточный канцерогенный риск (по окончании латентного периода) выражается как доля, или сомножитель, величины риска спонтанного возрастноспецифического рака в данной конкретной популяции. Учет последнего обстоятельства крайне важен, так как нередко за естественную частоту рака принимают либо данные по другим регионам, либо не учитывают, например, особенности этнического состава популяций, проживающих в данном регионе. Для них, как известно, характерны различия в спонтанных уровнях. Отсюда оцененная величина избыточного риска может не соответствовать действительной картине. Итак, модель мультипликативного (относительного) прогноза риска обязательно соотносит избыточный (радиогенный) риск со спонтанным риском злокачественных опухолей в возрастном аспекте. Например, относительный риск, оцененный по этой модели величиной 1,5, означает, что следует ожидать (прогнозировать) 50% рост риска сверх спонтанной частоты рака. Очень важно правильно трактовать обозначения и смысл величин, публикуемых в различных изданиях по этой проблеме. Относительный (мультипликативный) риск, равный 2, применительно к лейкозу с гигиенической точки зрения может показаться более значимым, чем относительный риск, равный 1,5, по отношению к раку молочной железы. (Совершенно очевидно, что для каждого конкретного человека противопоставление этих рисков бессмысленно, если у него развилась та или иная злокачественная опухоль.) С популяционных позиций оценки последствий облучения населения следует учитывать следующий факт: поскольку спонтанная частота лейкозов - крайне редкое событие, то и увеличение его в 2 раза обусловит в целом сравнительно малое число избыточных случаев этих гемобластозов. В то же время спонтанная заболеваемость раком молочной железы характеризуется существенно более высокими цифрами, так что коэффициент относительного риска 1,5 приведет к прогнозу гораздо большего абсолютного числа избыточных раков этого органа в популяции, нежели в случае лейкоза. Какие модели используются для прогноза канцерогенных рисков? После анализа этой проблемы МКРЗ предпочла мультипликативную модель для всех солидных раков. Исключение составляют лейкозы, оценка риска которых в результате облучения больше подходит под аддитивную модель. Действительно, хорошо известно, что относительно высокая спонтанная частота лейкозов характерна для детей и пожилых людей. Поэтому если бы мультипликативная мо- дель прогноза была справедлива для всех опухолей, включая лейкозы, то риск радиогенного лейкоза у детей и пожилых людей был бы намного завышен (для лейкоза риск уменьшается с увеличением возраста на момент облучения и оказывается не связанным напрямую со спонтанной частотой). В целом использование мультипликативной модели прогноза риска, по мнению некоторых ученых, приводит к более высоким оценкам риска, чем дает аддитивная модель. Данное различие в оценках риска может достигать коэффициента, равного 5. В табл. 8 представлены значения соответствующих коэффициентов вероятности стохастических последствий облучения. Таблица 8.Номинальные коэффициенты вероятности стохастических эффектов облучения, 10-2 Зв-1 (МКРЗ, 2002, Публикация 103)
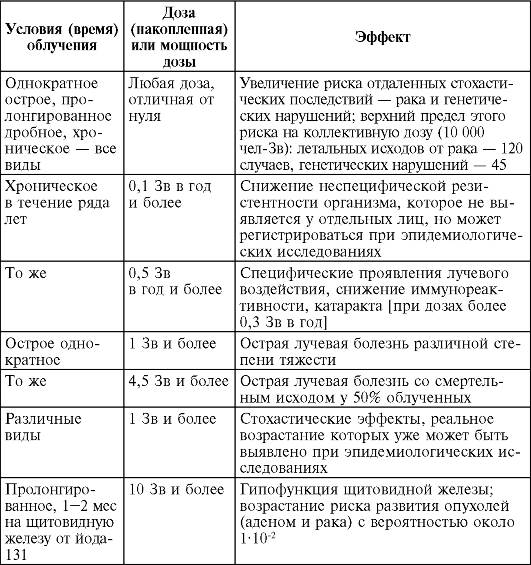
Численные значения приведенных в табл. 8 коэффициентов отнюдь не являются абсолютно точными, поскольку, как неодно- кратно подчеркивалось, они получены в результате целого ряда допущений. Укажем на одно существенное обстоятельство, на которое в большинстве случаев не обращают внимания: число рассчитанных с помощью этих коэффициентов событий (раки, наследуемые нарушения) - не строго фиксированная цифра, а некий диапазон цифр от нуля до максимального значения, в рамках которого находится теоретически оцениваемая величина. Поэтому крайне важно иметь в виду, что указанные коэффициенты, скорее, отражают порядок величин ожидаемых эффектов. В то же время вырванные из контекста цифры прогнозируемых ожидаемых случаев стохастиче- ских последствий облучения должны обязательно рассматриваться в сравнительном аспекте. Одним из таких сравнений в отношении, например, радиогенных злокачественных опухолей является на сопоставление их избыточности над спонтанным уровнем, «естественным фоном» этой патологии. Проведем грубый расчет. Согласно современным данным, смертность от рака составляет 200 случаев в год на 100 000 населения. Следовательно, из приведенного выше примера в когорте населения численностью 10 000 человек этот показатель составит 20 случаев в год. Примем среднюю продолжительность жизни 69 лет. За этот период по формальному расчету в данной популяции следует ожидать около 1400 случаев смерти от спонтанных злокачественных опухолей. В нашем примере (1?103 чел-Зв) число избыточных радиогенных раков составит 55 случаев. Таким образом, в результате облучения населения численностью 1?104 человек в средней индивидуальной дозе 0,1 Зв 1?103 чел-Зв ожидаемый выход злокачественных опухолей составит порядка 0,3% по сравнению со спонтанным уровнем. Приводим теперь два конкретных примера оценок радиологических последствий Чернобыльской аварии. Так, по нашим данным (1991), ожидаемая эффективная коллективная доза общего внешнего и внутреннего облучения (в основном за счет радиоактивного цезия) населения 9 областей России, Украины и Белоруссии (15 617 000 человек) составила 192 000 чел-Зв. Расчет показывает, что теоретически прогнозируемая смертность от всех злокачественных опухолей за счет радиации Чернобыля могла увеличиться на 0,6% по сравнению со спонтанным уровнем. Согласно данным 1995 г., эффективная коллективная доза 2,4 млн людей, проживающих на территории Украины, с уровнем радиоактивного загрязнения цезием-137 выше 37 кБк/м2, составила порядка 20 000 чел-Зв (с учетом доз, полученных в острый период после катастрофы, в том числе и на щитовидную железу). Используя тот же подход к оценкам пожизненного выхода радиационно-индуцированных опухолей, легко показать, что в данном случае речь идет о десятых долях процентов суммы избыточных опухолей по отношению к их спонтанному уровню. Выявление этого сравнительно малого числа избыточных раков на фоне высокого уровня спонтанных раков, годовые колебания которого находятся в пределах нескольких процентов, представляет исключительные трудности. Во-первых, в связи со статистическими ограничениями при проведении широкомасштабных эпидемиологических наблюдений за облученными и контрольными когортами населения (подробнее см. выше) и, во-вторых, из-за отсутствия тест-систем, с помощью которых можно дифференцировать раки радиогенной природы от обычных, спонтанных (как известно, по типу и гистологическому строению они одинаковы). Применительно к прогнозу серьезных генетических эффектов у потомков облученных людей (К = 1?10-2 Зв-1) можно привести следующие примеры. Если, скажем, каждый человек в когорте численностью 1 млн был облучен дозой 0,1 Зв, вероятность такого рода эффектов, как показывают расчеты, может проявиться среди 1000 потомков облученных у всех последующих поколений. Согласно нашим оценкам, теоретически ожидаемый выход генетических последствий среди жителей 9 областей России, Украины и Белоруссии, подвергшихся радиоактивному загрязнению в результате аварии на ЧАЭС, их прогнозируемая частота составит немногим более 100 случаев на 1 млн человек. Если учесть высокий спонтанный уровень клинически значимых наследственных заболеваний человека (50 000 врожденных аномалий развития и около 15 000 генетически обусловленных болезней на 1 млн живорожденных детей), становятся очевидными практически непреодолимые затруднения в выявлении этих теоретически возможных избыточных случаев наследственных заболеваний. Действительно, ряд ученых пришли к выводу, что «генетические последствия облучения участников ликвидации последствий аварии на ЧАЭС и эвакуированного населения тонут в высоком уровне спонтанных генетических нарушений». МКРЗ также оценила номинальные коэффициенты «вероятности выхода раков» для отдельных органов и тканей. Вскоре после катастрофы на 4-м энергоблоке ЧАЭС ученыммедикам стало очевидно, что одним из основных радиологических последствий аварии могут стать патологические нарушения щи- товидной железы. В связи с высокими уровнями поступления и избирательного поглощения радиоактивного йода в щитовидной железе (особенно у детей) дозовые нагрузки на железу оказались весьма высокими (средние дозы у детей достигали десятков сГр) и во многих случаях индивидуальные дозы превышали пороги детерминированных эффектов. В то же время с учетом широкого диапазона «йодных» доз облучения больших когорт населения стало очевидным, что через несколько лет (по завершении минимального латентного периода) должна проявиться и опухолевая патология. Благодаря своевременно организованному эпидемиологическому скринингу в России, на Украине и в Белоруссии уже спустя 3-4 года стали достоверно выявляться злокачественные опухоли щитовидной железы. В данном случае определяющую роль сыграли два фактора: крайне низкий уровень спонтанных раков щитовидной железы (особенно у детей: 1 случай на 1 млн человек в год) и высокие дозовые нагрузки на этот орган. Знание всех этих особенностей имеет принципиальное значение для планирования эпидемиологических исследований, посвященных выявлению стохастических последствий облучения у людей. Наконец, о прогнозе облучения плода. В период начала формирования органов и тканей (3 нед после зачатия) облучение может вызвать глубокие пороки их развития. Эти эффекты, по современным данным, являются детерминированными. Их порог для человека, оцененный на основании опытов над животными, составляет 0,1 Гр. К категории детерминированных эффектов относят также тяжелую умственную отсталость у детей, облученных в утробе матери между 8 и 15 нед беременности. Эти данные, полученные всего на 13 японских детях, матери которых подверглись атомной бомбардировке, тем не менее, были тщательно изучены. Показано увеличение частоты появления детей с этой патологией, связанное с дозой облучения. При этом избыточная вероятность тяжелой умственной отсталости составила 0,4 на 1 Зв, т.е. при облучении срав- нительно большой дозой и ее большей мощности примерно у 40% живорожденных детей в последующем может развиться эта форма повреждения. При дозах порядка 0,2 Зв данная форма поражения не наблюдается (в Чернобыльской аварии такие дозы облучения плода у беременных практически не достигались.) В период после 3 нед от зачатия и до конца беременности, по-видимому, вследствие облучения могут возникать стохастические эффекты в виде увели- чения вероятности фатальных злокачественных опухолей у живорожденных детей. Несмотря на то что данные по этой проблеме весьма неопределенны, МКРЗ, чтобы исключить любую недооценку подобного рода возможных эффектов облучения, принимает (без рекомендации численных значений) величину S, в несколько раз превышающую данный коэффициент для популяции в целом. В табл. 9 представлены сводные данные об основных эффектах облучения человека. Таблица 9.Основные клинические эффекты воздействия ионизирующей радиации на человека

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|