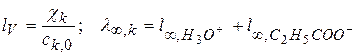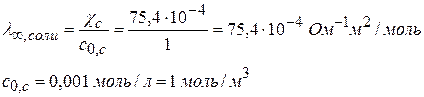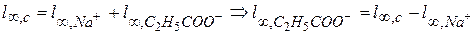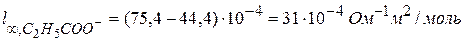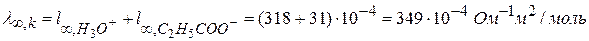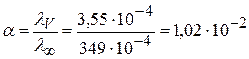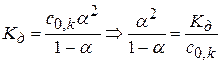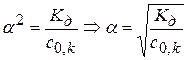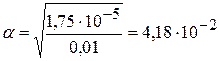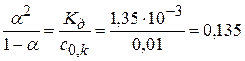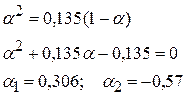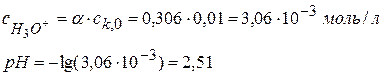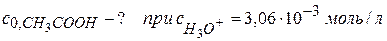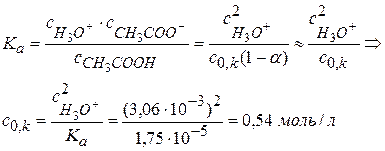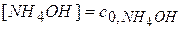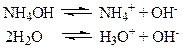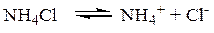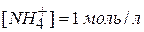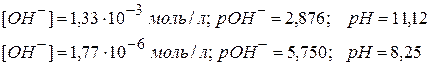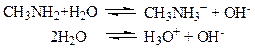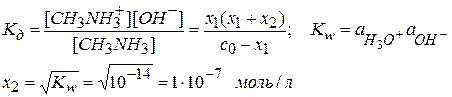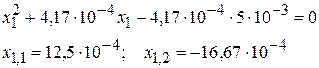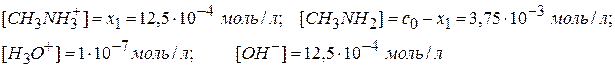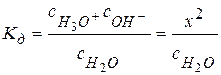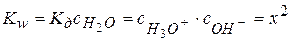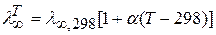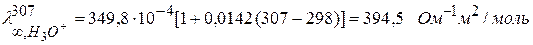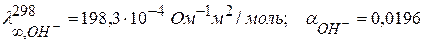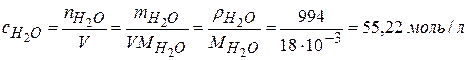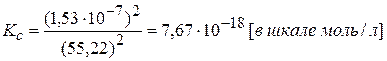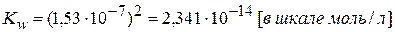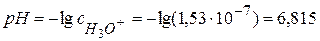|
|
Тема 4: Определение порядков химических реакции12 Задача № 1 Для гомогенной реакции А+В=С дана зависимость сА = f(τ). Построить кинетическую кривую, рассчитать константу скорости реакции, определить интегральным методом порядок реакции, определить время получения 50% фосгена от максимально возможного при 27 0С. СО+Сl2=COCl2
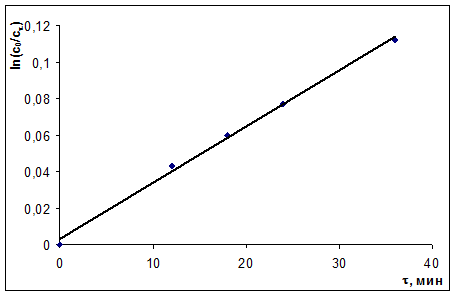
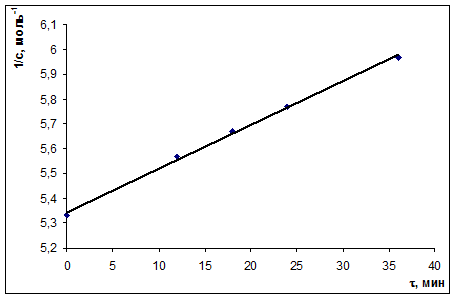
Решение: 1. Построим кинетическую кривую сСО = f(τ). По виду кинетической кривой можно определить, что это реакция II порядка. 2. Определение порядка реакции интегральным методом Если реакция I порядка – ln(c0/cτ) = f(τ), если II порядка, то должна быть прямая в координатах 1/сτ = f(τ)
При анализе графических зависимостей ln(c0/cτ) = f(τ) и 1/сτ = f(τ) можно сделать вывод, что это реакция II порядка – все точки лежат на одной прямой. 3. сСО = сCl2, интегральное кинетическое уравнение реакции II порядка:
4. Рассчитаем τ1/2 для реакции II порядка:
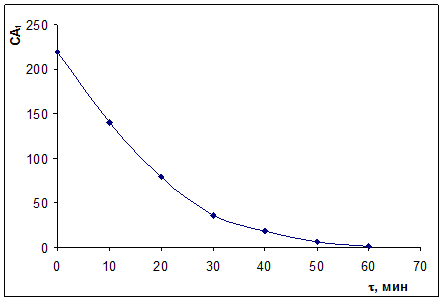
Задача № 2 Для гомогенной реакции A1+A2+А3 = В дана зависимость А1 от времени, причем с0,А2 и с0,А3 значительно больше с0,А1. Постройте кинетическую кривую сА1 = f(τ), определите по ней дифференциальным методом частный порядок реакции по веществу А1 и эффективную константу скорости реакции (по методу изолирования Оствальда). Решение: A1+A2+А3 = В; с0,А2 >> с0,А1 и с0,А3 >> с0,А1, тогда скорость реакции главным образом будет зависеть от сА1
1)
По данным построим кинетическую кривую сА,1 = f(τ).
2) Логарифмируя, получим:
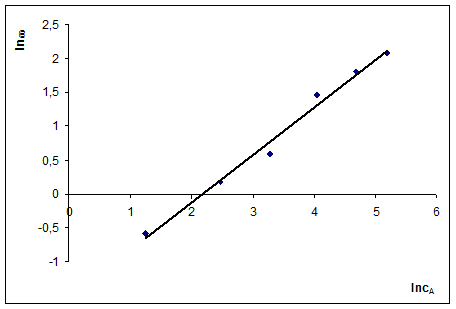
Строим график в координатах ln(ω) = f(lncA1). Но для начала проведем соответствующие расчеты и сведем их в таблицу:
3) Рассчитаем порядок по компоненту А1
Частный порядок реакции по А1 равен 0,7 4) Рассчитаем из графика кэфф. Отрезок, отсекаемый по оси ординат равен lnkэфф = −1,53 => кэфф = exp[−1,53]=0,216 Задача № 3 В реакции омыления эфира щелочью получены экспериментальные данные:
Определить порядок реакции методом подстановки и по Раковскому (по времени полупревращения). Решение: 1) Метод подстановки. I порядок
Максимальное отклонение от кср 22%. Разница в значениях k значительная. II порядок (сА,0 = сВ,0)
Максимальное отклонение от kср 7%. Расчет константы скорости реакции говорит о том, что это реакция II порядка. 2) По Раковскому По кинетической кривой cNaOH = f(τ) τ1/2 = 23 мин II порядок реакции I порядок Тема 5: Сложные химические реакции Задача № 1 Реакция разложения изопропилового спирта в присутствии катализатора VO3 при 590 К протекает по схеме:
Все три реакции I порядка. Исходная концентрация изопропилового спирта составляет 45 моль/м3; значение констант к1 = 4,95·10-2 с-1, к2 = 5,42·10-2 с-1, к3 = 1,135·10-2 с-1. 1) определите концентрации С3Н6О, С3Н6 и С3Н8 ко времени 5 с. 2) Рассчитайте время, к которому концентрация С3Н7ОН уменьшится на 75%. Решение
Найдем концентрации продуктов реакций к τ = 5 с по формуле:
Рассчитаем время, к которому концентрация изопропилового спирта по сравнению с начальной уменьшится на 75%:
Задача № 2 Обратимые реакции Превращение γ-оксимаслянной кислоты в γ-лактон, протекающее в водный среде является обратимой мономолекулярной реакций
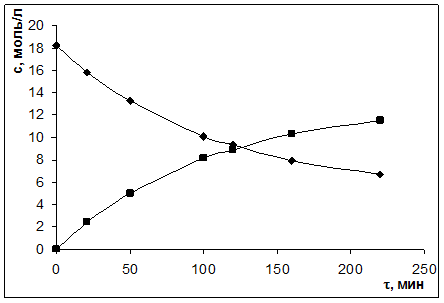
В результате проведенных опытов были получены следующие данные:
Начальная концентрация оксимасляной кислоты равна 18,23 моль/л. Рассчитайте константу равновесия реакции, константу прямой и обратной реакции; постройте кинетические кривые скисл = f(τ) и слакт = f(τ) Решение: Схематически представим реакцию следующим образом
Кинетика обратимых реакций описывается следующим уравнением: 1) 2) 3) Суммарная скорость обратимых реакций выражается системой уравнений:
сВ = хτ; сА,τ = с0-хτ. Рассчитываем сА и сВ.
Рассчитываем значение (к1+к2):
Совместно решим два уравнения:
Решение дает:
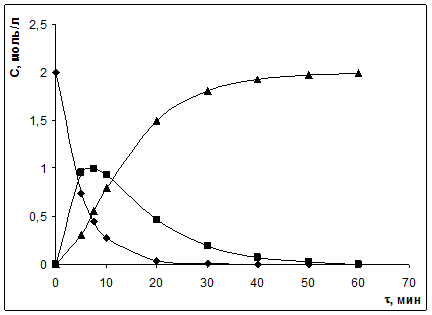
Задача № 3 Последовательная реакция первого порядка протекает при температуре 298 К по схеме:
Начальная концентрация вещества А равна 2 моль/л, значение к1 = 0,2 мин-1; к2 = 0,1 мин-1. 1) Постройте кинетические кривые: сА = f(τ), cB = f(τ), сД = f(τ). 2) Вычислите координаты максимума кинетической кривой cB = f(τ) и сравните с данными из графика. 3) В какой момент времени концентрации исходного и промежуточного веществ будут равны? Решение:
К любому времени τ сА,0 = (сА,0 – х)+(х – у)+у Кинетические уравнения прямой реакции:
Концентрация промежуточного соединения:
Концентрация конечного продукта:
Координаты максимума кинетической кривой сВ = f(τ)
Если к2/к1 = 2, то
Рассчитаем концентрации всех реактантов ко времени τ, данные сведем в таблицу; построим кинетические кривые:
Определим max сВ = f(τ):
Равенство концентраций исходного и промежуточного веществ – точка пересечения кинетических кривых сА = f(τ), cB = f(τ). При τ = 4 мин, с ≈ 0,88 моль/л. Кривая 1: Кривая 2: Кривая 3:
Из графика τmax = 7 мин, (x – y)max = 1 моль/л. Электрохимия Тема 6: Электрическая проводимость и подвижность ионов Задача № 1 Для 0,01 М раствора хлорида калия ρ = 709,22 Ом·см. Вычислите удельную и молярную электрические проводимости. Решение: 1) 2) Молярная электрическая проводимость рассчитывается по формуле
Задача № 2 Ток в 0,1 А в течение 2 час проходил через водный раствор цианида меди CuCN. На катоде выделилось 0,3745 г меди и наблюдалось выделение Н2 (н.у.: 1 атм, 273 0С). Какой выход по току при получении меди (ψСu) и каков объем выделившегося газа, если нет других побочных процессов?
Решение 1)Электрохимические реакции: Основной процесс.
Побочный процесс:
2) Определим выход по току По закону Фарадея:
Следовательно, на восстановление водорода пошло 100 – 78,4 = 21,6 % от общего количества тока I. 3) Рассчитываем массу водорода:
4) При н.у., полагая, что Н2 – идеальный газ, получаем:
Задача № 3 Анилин получается на свинцовом катоде в кислой среде по уравнению: С6H5NO2 + 6e + 6H+ = C6H5NH2 + 2H2O Выход по току 90%, напряжение 1 В. Найдите объем выделившегося водорода при Т = 298 К и Р = 0,9·105 Па, если получен 1 кг анилина. Определить расход энергии в кВт-час.
Решение: 1) Найдем расход энергии:
Из второго закона Фарадея выразим Iτ:
2) Расчет объема выделившегося Н2
Задача № 4 По нижеприведенным данным найти предельную электропроводность соли KClO3 при 18 0С:
Чему равна подвижность хлорат – ионов, если число переноса для него в KClO3 равно 0,462 Дано: Т = 180С = 291 К, n_ = t_ = 0,462 ________________________________________________ Найти:λ ∞.,KClO3 – ? λ ∞.,ClO3- – ?
Решение: В основу расчета положен закон Кольрауша независимого движения ионов.
Числа переноса
1) Найти значение λ ∞.,KClO3 можно сходя из λ ∞.,NaClO3, λ ∞.,KCl, λ ∞.NaCl. 2)
3) Задача № 5 Измерение электрической проводимости 0,03 М раствора СН3СООН проводился при l = 2·10-2 м и площади электродов s = 3·10-4 м2. При напряжении в 10 В через раствор идет ток I = 4,3·10-3 А при 298 К. Определить степень и константу диссоциации кислоты, если при этой температуре λ ∞,Н3О+ = 34,982 Ом-1м2/кмоль и λ ∞,СН3СОО- = 4,09 Ом-1м2/моль. Определить рН.
Решение: 1) СН3СООН+Н2О ↔ СН3СОО- + Н3О+ х1 2) Н2О + Н2О ↔ Н3О+ + ОН- х2
По 2 реакции [H3O+] = Kw0.5 = 10-7 моль/л, значительно меньше, чем по 1 реакции; рН определяется 1 реакцией 1) Рассчитываем α:
2) Рассчитываем Кдис:
3) рН раствора:
Тема 7: Теория электролитической диссоциации. Слабые и сильные электролиты Сильные электролиты диссоциируют нацело; диссоциация слабых электролитов характеризуется степенью диссоциации
α – степень диссоциации слабого электролита; У сильных электролитов α ≈ 1. Задача 1 Найти показатель константы диссоциации пропионовой кислоты С2Н5СООН по следующим данным: электропроводность 0,135 М раствора этой кислоты при 18 0С равна 4,79·10-2 Ом-1м-1, а электропроводность 0,001 М раствора пропионата натрия равна 7,54·10-3 Ом-1м-1. Подвижность ионов натрия 44,4 Ом-1м2/моль, а протона водорода – 318·10-4 Ом-1м2/моль.
Решение Запишем выражение для Кд кислоты:
Тогда 1) 2) Рассчитаем значение α = lV/l∞
Для расчета λ∞ нет значения l∞, С2Н5СОО-. Найдем его, зная электропроводность соли, считая, что при концентрации 0,001 моль/л раствор достаточно разбавлен. Диссоциация соли происходит нацело «нацело» С2Н5СООNa↔С2Н5СОО- + Na+
Расчет Кд пропионовой кислоты
В справочниках константы диссоциации Кд = Ка приводятся в шкале моль/л. Кд по справочнику равно 1,34·10-5, рКа=4,874.
Задача № 2 Для уксусной кислоты рКа = 4,756, а для монохлоруксусной – 2,870. Найти степень диссоциации, концентрацию ионов гидроксония Н3О+ и значение рН 0,01 М растворов кислот. Какая необходима концентрация CH3COOH, чтобы кислотность ее раствора равнялась кислотности 0,01 молярного раствора СН2ClCOOH? Решение: Для одноосновных кислот:
Допускаем, что α<<1, тогда
1) СН3СООН: рКа = рКд = 4,756; lgКа = − 4,756; Ка = 1,75·10-5
Если α ≈ 0, то нужно решать квадратное уравнение
2) CH2ClCOOH:рКа = рКд = 2,870; Ка = 1,35·10-3
3)
Задача № 3 Рассчитать концентрацию OH- в 0,1 М растворе гидроксида аммиака, содержащем 1 моль хлорида аммония. Покажите, как изменится рН раствора NH4OH при добавлении к нему NH4Cl. Решение: Из справочника Кд,NH4OH = 1,77·10-5, слабодиссоциируемое соединение, поэтому считается, что 1. Уравнения ионных реакций:
2. При добавлении 1 моль хлорида аммония, эта соль диссоциирует нацело (α=1)
Можно принять, что
Вывод: Добавление к раствору NH4OH хлорида аммония равновесие сдвигается влево, концентрация гидроксид – ионов уменьшается, рН становится меньше.
Задача № 4 Записать уравнения ионных уравнений, условие материального баланса и условие электронейтральности, а так же найти концентрацию всех типов частиц в 0,005 М водном растворе метиламина. Решение: Из справочника КВ = 4,17·10-4 – метиамин – слабое основание. Уравнение ионных реакций:
Равновесные концентрации частиц:
Тогда
Сделаем допущения х1>>х2, отсюда
Решаем квадратное уравнение:
х1,2 не имеет физического смысла. С учетом этого:
Условие электронейтральности:
Уравнение материального баланса по катиону:
Задача № 5 Удельная электропроводность чистой воды при 307 К составляет 9,62·10-6 Ом-1м-1. Вычислить константу ионизации, ионное произведение воды и рН. Решение: Реакция автопротолиза воды: 2Н2О ↔ Н3О+ + ОН- (Со−х) х х Константа автопротолиза воды
Константа ионизации воды
Ионное произведение воды Kw:
Удельная электропроводность воды
Подвижность при температуре Т можно найти через эмпирическую формулу:
где α – температурный коэффициент электропроводности Рассчитаем λ∞,Т. Из справочника:
Найдем х:
Вычислим концентрацию воды:
Вычислим искомые величины:

12 Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
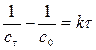 =>
=> 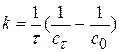
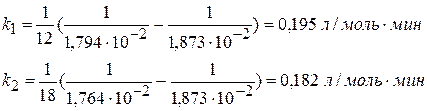

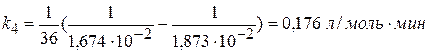


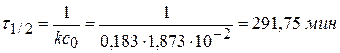
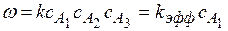
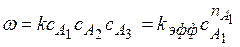
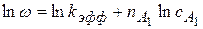

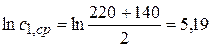
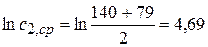
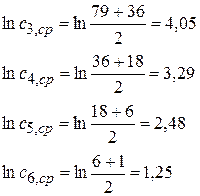
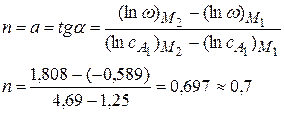

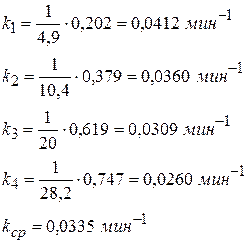
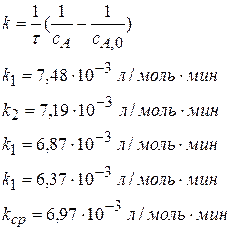
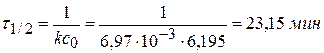
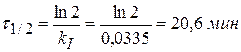
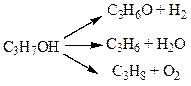
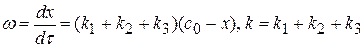
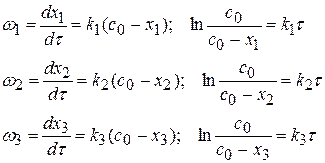
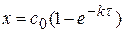

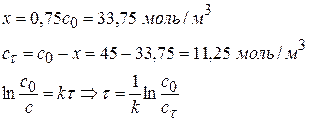

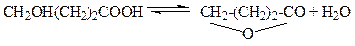
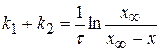

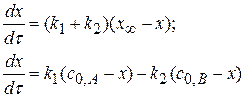

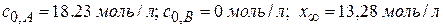

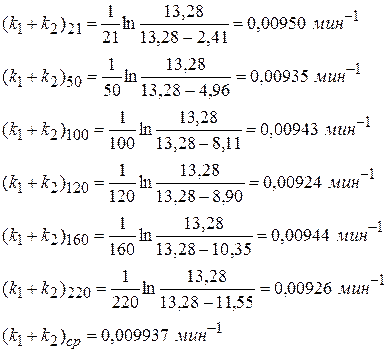

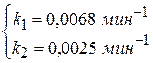
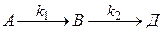
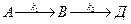

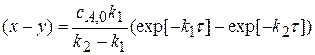



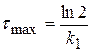
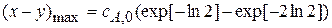
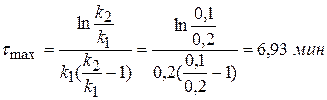
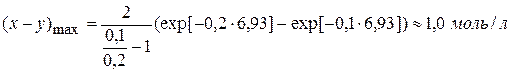
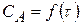
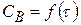
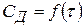
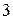
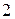
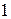

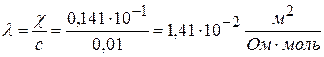
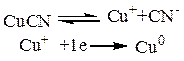
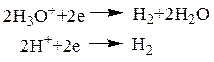
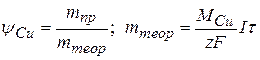
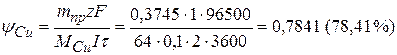
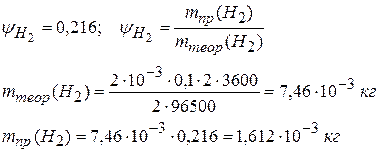
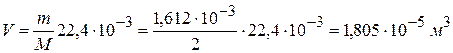
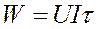
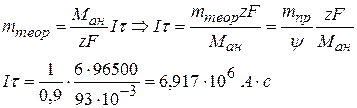
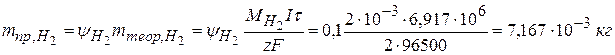
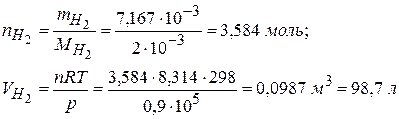
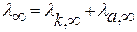
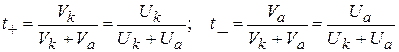
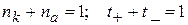

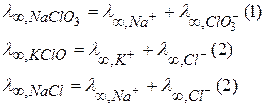

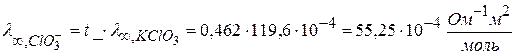


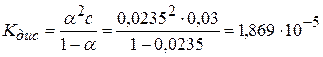
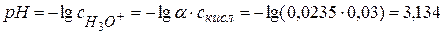



 и
и