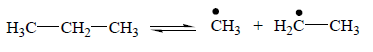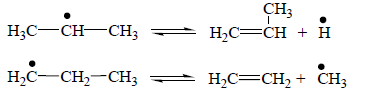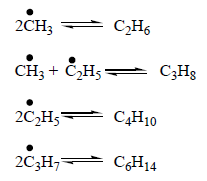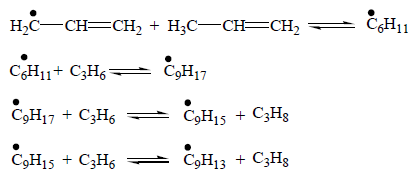|
|
Химические основы производства12 Содержание
ВВЕДЕНИЕ Этилен и пропилен являются важнейшими мономерами промышленного органического синтеза. На основе этилена осуществляется промышленное производство этанола, этилбензола, окиси этилена, полиэтилена, дихлорэтана, ацетальдегида и многих других химических продуктов. Пропилен в больших количествах используется для получения изопропилбензола, полипропилена, изопропилового спирта, окиси пропилена, глицерина и т. д. Поэтому производство низших олефинов осуществляется в крупных масштабах и непрерывно растет. Мировое производство этилена составляет около 60 миллионов тонн в год, а производство пропилена составляет примерно 40% от объема производства этилена. Для производства низших олефинов могут быть использованы различные источники углеводородного сырья. Их можно выделять из нефтезаводских газов. Прямое выделение этилена из нефтезаводских газов НПЗ имеющего типовой набор установок топливного варианта, обеспечивает объем производства этилена около 0,4% масс на перерабатываемую нефть. Поэтому настоящее время большую часть низших олефинов получают на специальных установках путем пиролиза этана, пропана, бутанов, бензина, керосино-газойлевых фракций и сырой нефти. Данные о производстве Производство пиролиза углеводородов нефти, компримирования, очистки и разделения пирогаза (объект 2-3-5/III) производства синтетического этилового спирта открытого акционерного общества “Уфаоргсинтез” предназначено для получения этилена, пропилена, бутилен-бутадиеновой фракции путем пиролиза бензина и углеводородных фракций с последующей низкотемпературной ректификацией. Производительность объекта по этилену 60 тысяч тонн в год. Объект введен в действие в сентябре 1968 года. Вырабатываемый этилен используется для получения полиэтилена, блок- и стат- сополимеров этилена с пропиленом, пропилен используется в производстве изопропилбензола и полипропилена, бутилен-бутадиеновая фракция является товарным продуктом. Проект выдан в 1964 году. Генеральный проектировщик предприятия - “Гипрокаучук”. Дополнительные работы выполнены “Башгипронефтехимом” и проектно-конструкторским отделом ОАО “Уфаоргсинтез”.
Химические основы производства Пиролиз — наиболее жесткая форма термического крекинга нефтяного и газового сырья, осуществляемая, обычно, при 700-900 ˚С для получения углеводородных газов с высоким содержанием непредельных соединений. Процесс термического разложения углеводородов, состоящий из многих элементарных реакций, которые протекают одновременно и последовательно, условно можно расчленить на две последовательные реакции. На первой стадии протекают первичные реакции термического расщепления алканов и циклоалканов с образованием олефинов, диолефинов и алканов с меньшим, чем у исходных углеводородов или равным числом атомов углерода, а также водорода. На второй стадии образовавшиеся олефины и диолефины подвергаются реакциям дегидрирования, дальнейшего расщепления и конденсации с образованием циклических ненасыщенных (циклополиенов) и ароматических углеводородов. В дальнейшем ходе реакции получаются все более сложные многоядерные ароматические углеводороды, что в конечном итоге приводит к образованию твердой пленки углерода, так называемого, пиролизного кокса. Последний может образоваться и при прямом разложении углеводородов на углерод и водород. В промышленных условиях осуществления процесса пиролиза (давление, близкое к атмосферному, и температура порядка 1000-1150 К) реакции разложения углеводородов протекают в газовой фазе в форме свободных радикалов. Свободные радикалы могут образоваться в процессах термического разложения из молекул исходного углеводорода, чаще всего при разрыве связи С–С, например, при пиролизе этана: С2Н6 → 2СН3• Практически разрывом связи С–Н в качестве первичного акта пиролиза можно пренебречь. Энергия разрыва связей С–С и С–Н в молекулах алканов не одинакова для всех однородных связей и изменяется в зависимости от строения молекулы и положения в ней связи. В молекулах олефинов и ароматических углеводородов связи С–С и С–Н, соседние с двойной связью, значительно прочнее, чем таковые в молекулах алканов, а такие же связи в положении через одну от двойной (сопряженные связи, или связи в β-положении) сильно ослаблены по сравнению с такими же связями в молекулах алканов. Радикалы могут образовываться не только при мономолекулярных, но и при бимолекулярных реакциях из молекул олефинов в реакциях диспропорционирования либо из молекул алканов и олефинов в реакциях, обратных диспропорционированию, например: 2С3Н6 →С3Н5• + С3Н7• С3Н8 + С3Н6 → 2С3Н7• Чем ниже температура и выше давление в реакционной системе, тем выше соотношение скоростей би- и мономолекулярного маршрутов образования радикалов. Соотношение энергий разрыва различных связей С–С и С–Н в молекулах реагирующих углеводородов определяет скорость реакций радикалов по тем или иным направлениям, количество образующихся различных радикалов и в итоге состав продуктов реакции. Ниже рассмотрены основные реакции радикалов, протекающие в реакторах пиролиза. Реакции замещения (отрыва атома водорода): СН3• + С3Н8 → СН4 + С3Н7• СН4 + СН3СН2СН2• → СН3• + С3Н8 Реакции присоединения. Радикалы могут присоединяться к молекулам ненасыщенных углеводородов по кратной связи, например: СН3• + С2Н4 → СН3СН2СН2• Реакции распада. Практически исключительное направление распада радикалов наблюдается по связи, находящейся в β-положении относительно атома углерода, обладающего свободной валентностью. В результате распада образуется молекула ненасыщенного углеводорода и радикал меньшей молекулярной массы, чем исходный, например: СН3СН2СН2СН2СНСН2СН3• → СН3• + С6Н12 Реакции изомеризации. Изомеризация радикала представляет собой внутримолекулярный отрыв атома водорода активным атомом углерода, обладающим свободной валентностью. Реакции изомеризации протекают через промежуточное состояние - циклические активированные комплексы. Легче всего образуются шестичленные, труднее – пяти- и семичленные активированные комплексы. Образование активированных комплексов, содержащих циклы с другим числом углеродных атомов, затруднено. Поэтому для радикалов с неразветвленной углеродной цепью вероятен переход свободной валентности от n-го (по счету) к (n+4), (n+5) и (n+6) атомам углерода. Реакции рекомбинации. Это реакции присоединения двух радикалов, например, 2С2Н5• → С4Н10. Энергия активации реакции близка к нулю, но в случае рекомбинации двух атомов водорода и, возможно, атома водорода и радикала СН3• рекомбинация происходит только в результате тройного столкновения, причем роль третьей сталкивающейся частицы заключается в отводе части энергии, выделяющейся при образовании связи. Реакции диспропорционирования. Диспропорционирование (перераспределение водорода) происходит в результате взаимодействия двух молекул олефинов или двух радикалов, например: 2С2Н5• → С2Н6 + С2Н4 Энергия активации этих реакций близка к нулю. Но, так как концентрации радикалов при термическом пиролизе обычно значительно меньше, чем углеводородных молекул, скорости реакций рекомбинации и диспропорционирования и роль их в образовании конечных продуктов (в реакционном объеме) обычно невелика. Реакции алканов. Термическое разложение алканов является чисто радикально-цепным процессом и протекает согласно механизму Райса-Герцфельда-Косякова. Пиролиз пропана включает следующие основные реакции: Реинициирование, заключающееся в быстром распаде этильного радикала
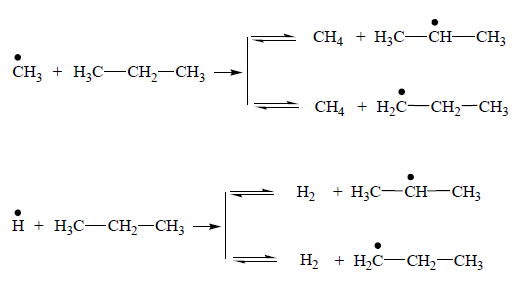
Передача и рост цепи. На этой стадии большую роль играют как радикал H•, так и метильный радикал CH3•, которые взаимодействуя с молекулой пропана порождают изо- или н-пропильные радикалы:
Образование изо- или н-пропильного радикала зависит от условий осуществления этой реакции. Так как энергия связи С–Н у первичного атома углерода выше, чем у вторичного атома углерода молекулы пропана, то при более высокой температуре образование н-пропильного радикала более вероятно. При более высокой температуре разница в энергиях связи С–Н первичного и вторичного атомов углерода становится незначительной. Так как первичных атомов водорода в 3 раза больше чем вторичных, то и вероятность отрыва первичного водорода выше. Поэтому при более высокой температуре (875°С) при пиролизе пропана больше образуется этилена, а при более низкой (780°С) имеет место максимальный выход пропилена. Рост цепи или продолжение цепи заключается в распаде пропильных радикалов:
Обрыв цепи заключается в столкновении двух любых радикалов, в результате чего образуются молекулы новых углеводородов, которые также участвуют в этих реакциях:
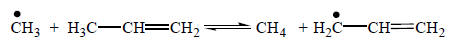
При пиролизе алканов изостроения наиболее вероятен разрыв связи С–С между двумя третичными атомами, затем между вторичным и третичным атомами, еще менее вероятен разрыв связи между первичным и третичным атомами и, наконец, наименее вероятен разрыв связи между двумя вторичными атомами углерода. Образовавшиеся радикалы, большие, чем СН3 и С2Н5, как правило, распадаются с разрывом ослабленной связи С– С, находящейся в β-положении к атому С, обладающему свободной валентностью. В схеме реакций пиролиза алканов учитывают изомеризацию первичных радикалов во вторичные через промежуточные, преимущественно шестичленные циклы. Реакции изомеризации эндотермичны (20-30 кДж/моль), следовательно, с повышением температуры равновесная концентрация вторичных радикалов снижается, что способствует увеличению скорости образования этилена. Реакции циклоалканов. Из циклоалканов в состав сырья для промышленного пиролиза входят только циклопентан, циклогексан и их алкилзамещённые. Основные продукты разложения циклопентана – этилен и пропилен, а при значительной степени разложения циклопентана образуется циклопентадиен. Реакция протекает преимущественно по радикально-цепному механизму. При пиролизе циклопентана вначале (через стадию образования бирадикала) образуются пентен-1, который распадается на этил- и аллилрадикалы, либо сумма этилена и пропилена. В дальнейшем, при повышении концентрации радикалов, они могут вступать в реакцию с исходным циклопентаном, отрывая от него водород. Образовавшийся циклический радикал разлагается по нескольким направлениям, образуя в конечном итоге этилен, циклопентадиен и водород. Циклогексан разлагается по аналогичной схеме с образованием на промежуточных стадиях гексена-1, циклического радикала, радикала С2Н3•, и, в конечном итоге, образует сумму следующих продуктов: этилен, ацетилен, этан, водород. В отличие от циклопентана циклогексан не дает при разложении заметных количеств циклогексадиена. Реакция его дегидрирования с образованием бензола также практически не наблюдается, но наряду с этиленом образуется бутадиен-1,3. Реакции олефинов и бутадиена-1,3. Олефины, как правило, не входят в состав сырья пиролиза. Однако низшие олефины и бутадиен-1,3 образуются на ранней стадии реакции пиролиза в значительных количествах, при этом также в небольших количествах получаются высшие олефины – С5 и выше. Наиболее вероятной реакцией зарождения цепи разложения этилена является диспропорционирование: 2С2Н4 → С2Н3• + С2Н5•. В присутствии активных радикалов Н и СН3 в зоне пиролиза зарождение цепи происходит в основном в результате взаимодействия их с этиленом: С2Н4 + R• → С2Н3• + RH (Н2, СН4). Основные продукты образуются по следующей схеме: С2Н3 + С2Н4 → С4Н7 + Н• С4Н7 → С3Н4 + СН3• С2Н3 → С2Н2 + Н• СН3 + С2Н2 → С3Н5• → С3Н6 + Н• С3Н5• + RH → С3Н6 + R• Бутадиен-1,3, как показывают экспериментальные данные, на дальнейших стадиях подвергается разложению с преимущественным образованием водорода, метана и этилена. Инициирование цепи в этом случае осуществляется при разложении бутадиена на радикалы С2Н3 с последующим разложением их на ацетилен атомарный водород. В дальнейшем реакция идет путем либо отрыва атома водорода от бутадиена-1,3 с последующим образованием бутенина, либо присоединения атома водорода с разложением по схеме превращения радикала С2Н3•. Образование жидких продуктов и кокса. Основным компонентом жидких продуктов пиролиза являются ароматические и алкилароматические углеводороды. Ароматические углеводороды образуются на поздней стадии термического разложения, когда в зоне реакции имеются в достаточной концентрации низшие олефины – этилен и пропилен. В процессе пиролиза наряду с первичными реакциями распада идут и реакции уплотнения, характеризующимися наличием стадии деградационной передачи цепи, при которой обрываются реакции распада и инициируется цепная реакция уплотнения, заключающаяся в последовательном присоединении олефина к аллильному радикалу с последующей циклизацией и перераспределением водорода. Обрыв цепи уплотнения происходит за счет реакций поликонденсации. Деградационная передача цепи заключается в столкновении радикала с олефином, в частности с пропиленом. При этом радикал превращается в молекулу, а пропилен в аллильный радикал.
При развитии цепи уплотнения к аллильному радикалу последовательно присоединяется олефин, в частности пропилен, с образованием радикала с большей молекулярной массой:
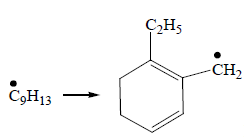
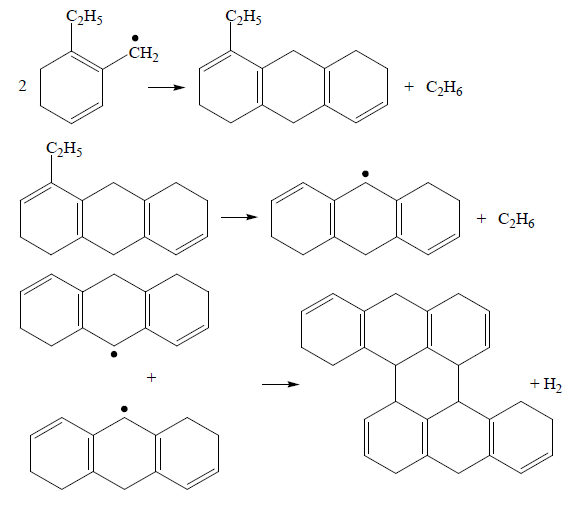
Циклизация. Обрыв цепи и уплотнение:
Молекулы могут конденсироваться на поверхности реакционной системы постепенно, образуя за счет дегидрогенизации пироуглерод (кокс), или могут образовать в газовой фазе стабильные жидкие капли (зародыши кокса), которые оседают в дальнейшем на поверхности либо формируют частицы кокса в объеме, уносимые далее из зоны реакции потоком пирогаза.
Технология производства 
12 Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|