
|
|
Константа химического равновесия12
Выведем константу равновесия для обратимых химических реакций (в общем виде)
Применим закон действия масс и запишем выражения скорости прямой и обратной реакций: · скорость прямой реакции: vпр. = k1[A]a[B]b(11) · скорость обратной реакции: vобр. = k2[N]n[M]m(12) · в состоянии равновесия:vпр. = vобр. , т.е. k1[A]a[B] b= k2[N]n[M]m (13) Переносим постоянные величины (константы скорости) в левую часть равенства, а переменные (концентрации) – в правую часть равенства, т.е. записываем данное равенство в виде пропорции:
Так как величиныk1 иk2 вопределенных условиях постоянны, то и отношение их тоже будет постоянной величиной для данной системы. Её обозначают К и называют константой равновесия.
В выражение константы входят равновесные концентрации веществ, взятые в степенях, равных коэффициентам перед веществом в уравнении реакции. Константа равновесия отражает глубину протекания процесса. Чем больше величина константы равновесия, тем выше концентрация продуктов реакции в момент равновесия, т.е. тем полнее протекает реакция. Константа равновесия зависит от природы реагирующих веществ, но не зависит от присутствия катализатора, так как он в равной степени ускоряет как прямую, так и обратную реакции. Влияние других факторов (концентрации веществ, давления газов и температуры) на величину константы равновесия мы разберем ниже на конкретных примерах Рассмотрим вывод выражения константы равновесия на конкретных примерах. Пример 2. для реакции: N2(г) +3H2(г) Û 2NH3(г) Vпр = k1[N2][H2]3 ; Vобр. = k2 [NH3]2.Если Vпр= Vобр.,то k1[N2][ H2]3 = k2[NH3]2, константа химического равновесия будет равна Если в реакции участвуют твердые вещества (гетерогенная система), то концентрация их не входит в выражение скорости реакции (т.к. остается постоянной в единице поверхности в единицу времени), а следовательно - константы равновесия. Пример 3. для реакции: С(тв.) + О2 (г) Û СО2(г) константа химического равновесия будет равна Пример 4. В обратимой химической реакции А + 2В Û Сравновесие наступило при следующих равновесных концентрациях: [А] = 0,6 моль/л; [В] = 1,2 моль/л; [С] = 2,16 моль/л. Определить константу равновесия и исходные концентрации вещества А и В. Решение. Вычисляем константу равновесия: чтобы определить исходные концентрации веществ А и В,нужно учесть, что согласно уравнению реакции А + 2В Û С из одного моля вещества А и двух молей вещества В образуется один моль вещества С. отсюда следует, что на образование каждых 2,16 молей вещества С пошло 2,16 моля вещества Аи 2,16·2=4,32 моля вещества В. Тогда число молей вещества А и В до начала реакции равнялось: [А]исх.=0,6+2,16=2,76 моль/л, [В]исх.=1,2+4,32=5,54 моль/л.
Смещение химического равновесия Состояние равновесия очень устойчивое, поэтому система может находиться в этом состоянии до тех пор, пока не изменятся параметры процесса: концентрации каких-либо веществ (или одного из реагентов), давление газовой смеси, температура. При этом вмешательстве извне изменяются скорости обеих реакций. Если обе скорости увеличиваются или уменьшаются в одинаковое число раз, т.е. сохраняется равенство vпр = vобр , то равновесие в данном случае не нарушается. Если изменение скоростей приводит к неравенствам vпр > vобр илиvпр < vобр, то происходит смещение равновесия в направлении процесса, идущего с большей скоростью. Направление смещения равновесия определяет принцип Ле-Шателье: если в системе, находящейся в состоянии равновесия, изменить одно из условий (концентрацию, давление или температуру), то равновесие смещается в направлении реакции, противодействующей данному изменению. Разберем влияние внешних факторов на смещение химического равновесия.
Влияние изменения концентрации веществ на смещение Химического равновесия Пример 5. какими изменениями концентрации веществ можно повысить выход водорода в реакции СН4 + СО2 Û 2СО + 2Н2 . Решение. Для повышения выхода водорода необходимо сместить равновесие вправо, то есть заставить ускоренно протекать прямую реакцию. По закону действия масс, скорость реакции прямо зависит от концентрации реагирующих веществ. Следовательно, для повышения выхода водорода нужно увеличить концентрацию метана СН4или диоксида углерода СО2 ,или обоих веществ вместе. С другой стороны, можно замедлить обратную реакцию, которая расходует образующийся водород, а замедление реакции связано с уменьшением концентраций реагирующих веществ, следовательно, чтобы повысить выход водорода, нужно уменьшить концентрацию оксида углерода СО или отводить из равновесной системы получающийся водородН2, тогда система будет стремиться повысить его выход. Таким образом, согласно принципу Ле-Шателье, увеличение концентрации веществ смещает равновесие в сторону той реакции, которая уменьшает их концентрацию, а уменьшение концентраций веществ смещает равновесие в сторону той реакции, которая их пополняет, увеличивает концентрацию. В данном случае константа равновесия Зная это, можно на основании выражения константы равновесия сделать вывод о направлении смешения равновесия при изменении концентрации веществ. Например, в данном случае уменьшение концентрации СО вызовет уменьшение числителя дроби. Чтобы дробь осталась неизменной, должен уменьшиться знаменатель, т.е. уменьшиться концентрация СН4иСО2, что соответствует ускорению прямой реакции и смещению равновесия вправо. 
12 Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 .
.
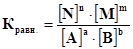 .
.
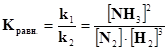 .
.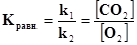 .
. .
.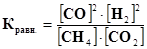 не изменится, т.к. согласно закону сохранения масс веществ увеличение концентрации одних веществ (например, СН4иСО2)вызывает увеличение во столько же раз концентрации других веществ (СОиН2).В результате величина дроби не изменится, т.е. константа равновесия не зависит от концентрации.
не изменится, т.к. согласно закону сохранения масс веществ увеличение концентрации одних веществ (например, СН4иСО2)вызывает увеличение во столько же раз концентрации других веществ (СОиН2).В результате величина дроби не изменится, т.е. константа равновесия не зависит от концентрации.