
|
|
Влияние температуры на скорость реакции.12 Саратовский государственный технический университет
Химическая кинетика. Химическое равновесие
Методические указания к выполнению лабораторных работ по общей химии для студентов всех специальностей
Одобрено редакционно-издательским советом Саратовского государственного технического университета
Саратов 2003
Цель работы: изучить влияние различных факторов (концентрации и температуры) на скорость химической реакции, ознакомиться с равновесным состоянием и факторами, влияющими на его смещение.
ОСНОВНЫЕ ПОНЯТИЯ Скорость химических реакций Химическая кинетика - учение о закономерностях протекания химических реакций. Кинетика рассматривает две важные и взаимосвязанные характеристики реакций: скорость и механизм, знание которых позволяет управлять реакциями, выбирать оптимальные условия для их протекания. скорость химической реакции определяется числом столкновений активных реагирующих частиц, происходящих в единицу времени в единице объема (для гомогенных реакций), или на единице поверхности раздела фаз (для гетерогенных реакций), приводящих к образованию нового вещества. за скорость химической реакции принимают изменение молярной концентрации вещества за единицу времени в единице реакционного пространства. При этом безразлично, какие из реагирующих веществ выбирать для наблюдения за скоростью, так как они связаны между собой одним уравнением реакции. Например, молярная концентрация одного реагирующего вещества в момент времени τ1 равна С1, а в момент времени τ2 равна С2 , тогда средняя скорость данной реакции
молярная концентрация показывает, сколько молей вещества содержится в 1 литре раствора или объема газовой смеси, время измеряется в секундах. Чтобы вычислить скорость реакции, нужно знать, как изменилась концентрация одного из реагирующих веществ за определенный промежуток времени. Чем меньше интервал времени, тем ближе экспериментально найденная скорость к истинной, то есть к скорости в данный момент. Скорость реакции всегда положительная величина, поэтому дробь берется со знаком минус в том случае, когда изучают изменение концентрации исходного вещества при реакции (С2<С1; Для определения скорости процесса можно выбрать реакцию, для которой появление определенного количества продукта фиксируется визуально, например, получение осадков. Таким образом, промежуток времени от момента слива растворов до появления осадка обратно пропорционален скорости реакции, поэтому 1/
где · от давления (в случае реакций с участием газов, так как с изменением давления изменяется концентрация); · от освещения; · от степени измельчения для реакции с участием твердых веществ.
Зависимость скорости реакции от концентрации. Закон действия масс Эта зависимость была открыта двумя норвежскими учеными – Гульдбергом и Вааге в 1867 году и русским ученым Бекетовым и названа законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степени, равной коэффициенту перед веществом в уравнении реакции. Для реакции aA + bB = mM + nN закон действия масс имеет вид:
где САили [A]- концентрация вещества А, моль/л; СВ или [В] -концентрация вещества В, моль/л (в дальнейшем в методических указаниях используется второй способ обозначения концентрации) ; а и в –коэффициенты в уравнении реакции; k– коэффициент пропорциональности, называемый константой скорости. Если принять, что [A]=[B]=1 моль/л, то v= k,то есть константа скорости k численно равна скорости реакции, если концентрации реагирующих веществ равны единице. Поэтому величина kзависит от природы реагирующих веществ, температуры и действия катализатора, а от концентрации не зависит и остается постоянной при данной температуре в течение всей реакции. Рассмотрим пример гомогенной химической реакции: 2NO(г) + O2 (г)
В гетерогенной системе "газ – твердое вещество" взаимодействие веществ возможно лишь на поверхности раздела фаз. В этом случае концентрация твердого вещества остается постоянной в единице поверхности и входит в константу скорости реакции, а скорость реакции зависит лишь от концентрации газообразного вещества. Например: С(т) + О2(г) = СО2(г),
При столкновении молекул реагирующих веществ взаимодействие происходит только в том случае, если соударяющиеся частицы обладают энергией, достаточной для разрыва связи в молекулах и преодоления сил взаимного отталкивания их электронных оболочек. Такие молекулы называют активными. Энергия, необходимая для разрыва связей в молекулах реагирующих веществ и для преодоления сил отталкивания электронных оболочек молекул или атомов реагирующих веществ, называется энергией активации и обозначается Еакт..
Влияние температуры на скорость реакции. Правило Вант-Гоффа Количественная зависимость скорости реакции от температуры выражается эмпирическим правилом Вант-Гоффа (1884 г.): при повышении температуры на каждые 100С скорость большинства реакций возрастает в 2-4 раза, а при понижении температуры на 100С скорость реакции во столько же раз уменьшается. Число, показывающее, во сколько раз увеличивается скорость данной реакции при повышении температуры на 100С, называется температурным коэффициентом скорости (γ).
Для большинства реакций это отношение колеблется в пределах от 2 до 4. Скорость реакции Vt2 при любой температуре t02 можно вычислить по формуле
где γ – температурный коэффициент; t01 – начальная температура; t02 – конечная температура; vt2 – скорость реакции при t02; vt1 – скорость реакции при t01. ПРИМЕР 1. Во сколько раз увеличится скорость химического процесса, если температура в системе повысилась с 800С до 1100С, т.е. на 300 при температурном коэффициенте γ=3? Решение. Ответ. Приповышении температуры с 800 до 1100С скорость реакции увеличится в 27 раз. С изменением температуры изменяется константа скорости. Поэтому зависимость скорости реакции от температуры можно выразить через отношение константы скорости при (t0 + 100) к константе скорости при t0
Более точно зависимость скорости реакции от температуры выражается уравнением Аррениуса
где k – константа скорости реакции; A – предэкспоненциальный множитель (зависящий от природы вещества); EА – энергия активации, Дж/моль; R – универсальная газовая постоянная, 8,3143 Дж/моль К; e – основание натурального логарифма (2,718) В химической кинетике часто пользуются уравнением Аррениуса в логарифмической форме
Из уравнения (8) следует, что зависимость константы скорости от температуры, построенная в координатах lnk –1/Т, линейна (рис.1) Эта зависимость позволяет определить энергию активации реакции EА по тангенсу угла наклона прямой и предэкспоненциальный множитель A по отрезку, отсекаемому на оси ординат, когда 1/Т=0

12 Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 .
.
 <0).
<0). называется относительной скоростью реакции.
называется относительной скоростью реакции. ,
,
 или
или
 2NO2 (г)
2NO2 (г)

 ,
,
 ,
,
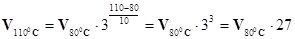
 ,
,
 Чем больше величина энергии активации, тем меньше доля активных частиц, столкновение между которыми ведет к химической реакции, то есть тем меньше константа скорости. Таким образом, экспоненциальный фактор e-E/RT выражает долю частиц от их общего числа, обладающих достаточным запасом энергии для протекания процесса в случае их столкновения.
Чем больше величина энергии активации, тем меньше доля активных частиц, столкновение между которыми ведет к химической реакции, то есть тем меньше константа скорости. Таким образом, экспоненциальный фактор e-E/RT выражает долю частиц от их общего числа, обладающих достаточным запасом энергии для протекания процесса в случае их столкновения.