
|
|
НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙСтупко Т.В.
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Конспект лекций для студентов 1 курса
ВВЕДЕНИЕ В различных реакциях, протекающих в растворе, мы обнаруживаем участие неизменных группировок атомов, выступающих либо в виде ионов (SO42- , OH-, NO2-, CO32-, NO2- ), либо в виде нейтральных молекул (NH3, CO, NO). Эти неизменные группировки атомов способны к взаимодействию в растворе с ионами металлов или нейтральными молекулами с образованием более сложных частиц. Например, ион Cu2+ взаимодействует в растворе с молекулами NH3 по обратимой реакции с образованием сложного катиона: Cu2+ + 4 NH3 Образовавшиеся новые соединения приобретают новые свойства, отличные от свойств составляющих их простых соединений, например, совершенно иную окраску, растворимость и способность взаимодействовать с различными реагентами. Так, иодид ртути(II) взаимодействует в растворе с нитратом серебра с образованием малорастворимого иодида серебра: HgI2 + 2 AgNO3 = 2 AgI¯ + Hg(NO3)2. После образования сложного соединения с иодидом калия по реакции HgI2 + 2 KI = K2[HgI4] . свойства иодида ртути(II) как индивидуального вещества исчезают. Продукт состава K2[HgI4] обладает другими химическими свойствами, поскольку образовавшийся сложный анион [HgI4]2- ведет себя в обменных реакциях как неразрывное целое: K2[HgI4] + 2 AgNO3 = Ag2[HgI4] + 2 KNO3 . Подобные сложные образования получили название комплексных ионов или молекул. В современной литературе отсутствует однозначное определение «комплексное соединение». Дело в том, что из-за огромного многообразия их строения и свойств ученые не могут договориться между собой, какое свойство брать в основу определения понятия «комплексное соединение». Один из авторитетнейших ученых в области изучения комплексных соединений академик А.А.Гринберг трактует комплексы как соединения, содержащие в своем составе комплексный ион, не разрушающийся при переходе этих соединений в раствор. Однако и это определение не относится ко всем комплексным ионам. Так, ион [AlCl4]- при растворении соли в воде переходит в [Al(H2O)6]3+. Существует еще одно определение: комплексным соединением называют сложное соединение, образующееся при взаимодействии более простых неизменных частиц (атомов, ионов или молекул), каждая из которых способна существовать независимо в обычных условиях.Но и оно не является однозначным, так как не всякое такое соединение является комплексным. Реакции, в результате которых образуются комплексные соединения, носят название реакций комплексообразования. Пример реакции комплексообразования – взаимодействие SnCl4 и Cl- с получением сложного комплексного аниона [SnCl6]2-: SnCl4 + 2 Cl- В то же время, например, перхлорат-анион ClO4- не является комплексным, поскольку простые неизменные группировки атомов, на которые он мог бы диссоциировать в обычных условиях, неизвестны. Комплексные ионы образуют с ионами противоположного заряда комплексные соединения. Так, комплексный ион [Fe(CN)6]3- образует с ионами K+ комплексное соединение K3[Fe(CN)6], которое выделяется из водного раствора при его выпаривании в виде кристаллов красного цвета, хорошо растворимых в воде. Комплексный катион [Cu(NH3)4]2+ образует с анионами SO42- комплексное соединение [Cu(NH3)4]SO4.2H2O, выделяющееся из раствора в виде темно-синих кристаллов, легко разлагающихся на воздухе и при небольшом нагревании. В дальнейшем комплексными соединениями, или просто комплексами, мы будем называть и комплексные ионы и комплексные молекулы. Комплексные соединения называют часто координационными, подчеркивая тем самым способность простых неизменных частиц определенным образом располагаться (координироваться) друг около друга в комплексном ионе или комплексной молекуле. Понятие «координационное соединение» шире, чем «комплексное соединение» (перхлорат-анион ClO4- координационное соединение, атомы кислорода координированы вокруг атома хлора). Природу химических связей в комплексах, их строение и принципы образования объясняет координационная теория. ОСНОВНЫЕ ПОНЯТИЯ КООРДИНАЦИОННОЙ ТЕОРИИ Основы современной координационной теории были изложены в конце XIX века швейцарским химиком Альфредом Вернером, обобщившим в единую систему весь накопившийся экспериментальный материал по комплексным соединениям. Им были введены понятия о центральном атоме и координационном числе, внутренней и внешней сфере комплексного соединения, изомерии, предприняты попытки объяснить природу химической связи в комплексах. Все основные положения координационной теории А.Вернера используются и в настоящее время. Исключение составляет его учение о природе химической связи, которое представляет сейчас лишь исторический интерес. Комплексообразователь. Образование комплексного иона или нейтрального комплекса можно представить себе в виде реакции общего типа: M + n L где M - нейтральный атом, положительно или отрицательно заряженный условный ион, объединяющий (координирующий) вокруг себя другие атомы, ионы или молекулы L. Атом M получил название комплексообразователя, или центрального атома. В комплексных ионах [Cu(NH3)4]2+, [SiF6]2-, [Fe(CN)6]4-, [BF4]- комплексообразователями являются медь(II), кремний(IV), железо(II), бор(III). Чаще всего комплексообразователем служит атом элемента в положительной степени окисления. Атом-комплексообразователь может обладать нулевой степенью окисления. Так, карбонильные комплексы никеля и железа, имеющие состав [Ni(CO)4] и [Fe(CO)5], содержат атомы никеля(0) и железа(0). Атомы в отрицательной степени окисления играют роль комплексо-образователей сравнительно редко. Комплексообразователь может участвовать в реакциях получения комплексов, как будучи одноатомным ионом, например: Ag++2NH3 так и находясь в составе молекулы: SiF4+2F- В комплексной частице может быть два и более атомов-комплексообразователей. В этом случае говорят о многоядерных комплексах, например [Fe2(CO)9]. Комплексное соединение может включать несколько комплексных ионов, в каждом из которых содержится свой комплексообразователь. Например, в одноядерном комплексном соединении состава [Сo(NH3)6][TlCl6] комплексообразователи Co3+ и Tl3+. Лиганды. В комплексном ионе или нейтральном комплексе вокруг комплексообразователя координируются ионы, атомы или простые молекулы (L). Все эти частицы, имеющие химические связи с комплексообразователем, называются лигандами. В комплексных ионах [SnCl6]2- и [Fe(CN)6]4- лигандами являются ионы Cl- и CN-, а в нейтральном комплексе [Cr(NH3)3(NCS)3] лиганды - молекулы NH3 и ионы NCS-. Лиганды, как правило, не связаны друг с другом, и между ними действуют силы отталкивания. В отдельных случаях наблюдается взаимодействие лигандов с образованием водородных связей. Лигандами могут быть различные неорганические и органические ионы и молекулы. Важнейшими лигандами являются ионы CN-, F-, Cl-, Br-, I-, NO2-, OH-, SO3S2-, C2O42-, CO32-, молекулы H2O, NH3, CO, (NH2)2CO, органические соединения - этилендиамин NH2CH2CH2NH2, α-аминоуксусная кислота NH2CH2COOH и т.п. Дентатность лиганда. Чаще всего лиганд бывает связан с комплексообразователем через один из своих атомов одной двухцентровой химической связью. Такого рода лиганды получили название монодентатных. К числу монодентатных лигандов относятся все галогенид-ионы, цианид-ион, аммиак, вода и другие. Существует целый ряд лигандов, являющихся в комплексах практически всегда бидентатными. Каждая молекула или ион бидентатного лиганда
Некоторые распространенные лиганды типа молекул воды H2O, гидроксид-иона OH-, тиоцианат-иона NCS-, амид-иона NH2-, монооксида углерода CO в комплексах преимущественно монодентатны, хотя в отдельных случаях становятся бидентатными. Полидентатные лиганды могут выступать в роли мостиковых лигандов, объединяющих два и более центральных атома. Координационное число. Важнейшей характеристикой комплексообразователя является количество химических связей, которые он образует с лигандами, или координационное число (КЧ). Эта характеристика комплексообразователя определяется главным образом строением его электронной оболочки и обусловливается валентными возможностями центрального атома или условного иона-комплексообразователя. Когда комплексообразователь координирует монодентатные лиганды, то координационное число равно количеству присоединяемых лигандов. Количество присоединяемых к комплексообразователю полидентатных лигандов всегда меньше значения координационного числа. Значение координационного числа комплексообразователя зависит от его природы, степени окисления, природы лигандов и условий, при которых протекает реакция комплексообразования. Значение КЧ может меняться в различных комплексных соединениях от 2 до 8 и даже выше. Наиболее распространенными КЧ являются 4 и 6. Между значениями координационного числа и степенью окисления элемента-комплексообразователя существует определенная зависимость.
Известны комплексообразователи, которые обладают практически постоянным координационным числом в комплексах разных типов. Таковы кобальт(III), хром(III) или платина(IV) с КЧ 6 и бор(III), платина(II), палладий(II), золото(III) с КЧ 4. Тем не менее большинство комплексообразователей имеет переменное координационное число. Например, для алюминия(III) возможны КЧ 4 и КЧ 6 в комплексах [Al(OH)4]- и [Al(H2O)2(OH)4]-. Координационные числа 3, 5, 7, 8 и 9 встречаются реже. Есть всего несколько соединений, в которых КЧ равно 12, например, K9[Bi(NCS)12]. Внутренняя и внешняя сфера комплексного соединения. Лиганды, непосредственно связанные с комплексообразователем, образуют вместе с ним внутреннюю (координационную) сферу комплекса. Так, в комплексном катионе [Cu(NH3)4]2+ внутренняя сфера образована атомом комплексообразователя - меди(II) и молекулами аммиака, непосредственно с ним связанными. Обозначается внутренняя сфера квадратными скобками: [Fe(CN)6]3-, [HgI4]2. В зависимости от соотношения суммарного заряда лигандов и комплексообразователя внутренняя сфера может иметь положительный заряд, например [Al(H2O)6]3+, либо отрицательный, например [Ag(SO3S)2]3-, либо нулевой заряд, например [Cr(NH3)3(NCS)3]0. Ионы, нейтрализующие заряд внутренней сферы, но не связанные с центральным атомом ковалентно, образуют внешнюю сферу комплексного соединения.
Изображая формулу комплексного соединения, внешнесферные ионы располагают за квадратными скобками. Например, в соединениях [Cu(NH3)4](OH)2 и K2[HgI4] внешнесферными ионами являются, соответственно, ионы OH- и K+. Вполне понятно, что в нейтральных комплексах [Cr(NH3)3(NCS)3]0 внешняя сфера отсутствует. Обычно внешнюю сферу составляют простые одноатомные или многоатомные ионы. Однако возможны случаи, когда комплексное соединение состоит из двух и более внутренних сфер, одна из которых является катионом, а другая – анионом. Здесь каждая из внутренних сфер является внешней по отношению к другой. Например, в соединении [Cu(NH3)4][PtCl6] формально функции внешнесферных ионов могут выполнять как комплексные катионы [Cu(NH3)4]2+, так и комплексные анионы [PtCl6]2- . НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Основы современной номенклатуры комплексных соединений были заложены А. Вернером. До его работ в этой области химии не существовало никакой системы. Комплексные соединения называли, руководствуясь их внешним видом, например, пурпуреосоль (красная соль) [Co(NH3)5Cl]Cl2, лутеосоль (желтая соль) состава [Co(NH3)6]Cl3, либо происхождением, например, красная кровяная соль K3[Fe(CN)6], либо давали имена химиков, синтезировавших их – соль Фишера K3[Co(NO2)6], соль Рейнеке NH4[Cr(NH3)2(NCS)4] . Современная номенклатура комплексных соединений основана на рекомендациях ИЮПАК (Международного союза общей и прикладной химии) и адаптирована к традициям русского химического языка. Названия лигандов. Названия анионных лигандов (ацидолигандов) получают концевую гласную - о, которой сопровождается название соответствующего аниона (или корня названия аниона):
*) гидро в соединениях с бором Иногда анионные лиганды имеют специальные названия, например: S2- – тио; O2- – оксо; HS- – меркапто. Анионы углеводородов в качестве лигандов называют так: CH3- – метил, C5H5- – циклопентадиенил. Для нейтральных лигандов используют номенклатурные названия веществ без изменений (N2 – диазот, N2H4 – гидразин, C2H4 – этилен и т.д.), кроме веществ, которые, выступая в роли лигандов, получают следующие специальные названия: H2O – аква; NH3 – аммин; NO – нитрозил; CO – карбонил; SO2 – диоксосера; PF3 – трифторофосфор. Громоздкие по написанию формулы органических лигандов заменяют полностью или частично буквенными обозначениями, например: NH2CH2CH2NH2 (этилендиамин) – en; P(C2H5)3 (триэтилфосфин) – PEt3; (NH2)2CO (карбамид) – ur ; C5H5N (пиридин) – py. Для катионных лигандов применяют следующие названия: N2H5+ – гидразиний; NO2+ – нитроилий; NO+ – нитрозилий. Порядок перечисления лигандов. Правила изображения формул комплексных соединений следующие. При составлении формулы одноядерного комплекса (ионного или нейтрального) слева ставят символ центрального атома, а затем перечисляют лиганды в порядке уменьшения их зарядов от положительных значений к отрицательным: [ML1+L20L3-]. При равенстве зарядов лигандов пользуются практическим рядом элементов. Например, H2O записывают левее NH3, C5H5N – левее CO. Более простые лиганды в формулах указывают левее более сложных; так, N2 пишут левее NH3, NH3 – левее N2H4, N2H4 – левее NH2OH. В формулах многоядерных комплексов указывают число центральных атомов, например [MXLY]. Названия веществ строят из названий лигандов с предшествующей числовой приставкой (греческое числительное), указывающей число лигандов каждого типа в формуле, и названия комплексообразователя в определенной форме. Причем перечень лигандов идет в соответствии с алфавитом(правила 1970 г.). Надо отметить, что в отечественной литературе чаще используется перечисление лигандов от отрицательного заряда лиганда к нейтральному и затем положительному, т.е. справа налево по формуле соединения.
Названия нейтральных комплексов. Названия комплексов без внешней сферы состоят из одного слова. Вначале указывается число и названия лигандов (для лигандов каждого вида отдельно), затем название центрального атома в именительном падеже (в случае многоядерных комплексов - с указанием числа центральных атомов). Например: [Fe(H2O)4Cl2] – дихлоротетраакважелезо(II); [Co2(CO)8] – октакарбонилдикобальт; [Zn(еn)2Cl2] – дихлоробис(этиленди-амин)цинк (слово «этилендиамин» содержит числительное, поэтому перед названием такого лиганда пишем сложное числительное «бис», а не «ди»). Названия соединений с комплексными катионами строятся так же, как и названия простых соединений, состоящих из катиона и аниона. Однако в рассматриваемом случае катион не простой, а комплексный. Названия комплексных катионов состоят из числа и названия лигандов и названия комплексообразователя (для многоядерных комплексов – с указанием их числа). Обозначение степени окисления комплексообразователя дают римскими цифрами в скобках после названия (по способу Штока): [Cr2(NH3)9(OH)2]4+ – катион дигидроксононаамминдихрома(III). В случае неизвестной степени окисления комплексообразователя указывают заряд всего катиона в скобках арабскими цифрами (по способу Эвенса-Бассетта). Например: [Hg2(H2O)2]2+ – катион диаквадиртути(2+). Названия соединений, включающих комплексный катион, строятся так: [Mn(H2O)6]SO4 – сульфат гексааквамарганца(II). Названия соединений с комплексными анионами строятся так же, как названия простых соединений, состоящих из катиона и аниона. Однако в рассматриваемом случае анион не простой, а комплексный. Название комплексного аниона строится из числа и названия лигандов, корня латинского названия элемента-комплексообразователя, суффикса -ат и указания степени окисления комплексообразователя: [BF4]- – тетрафтороборат(III)-ион 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
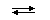 [Cu(NH3)4]2+ .
[Cu(NH3)4]2+ . [MLn], (заряды частиц для простоты опущены)
[MLn], (заряды частиц для простоты опущены)


 H2C - NH2
H2C - NH2
этилендиамин
H2C - NH2
H2C - NH2
этилендиамин
